
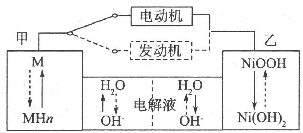
 ��������϶������������õ綯������ȼ������߽���ƶ��������������»����ʱ���綯���ṩ�ƶ������������͵����ģ���ɲ��������ʱ����ش��ڳ��״̬�����·����ԭ ����ͼ��ʾ������˵������ȷ���ǣ�������
��������϶������������õ綯������ȼ������߽���ƶ��������������»����ʱ���綯���ṩ�ƶ������������͵����ģ���ɲ��������ʱ����ش��ڳ��״̬�����·����ԭ ����ͼ��ʾ������˵������ȷ���ǣ�������| A����س��ʱ��OH-�ɼײ����Ҳ��ƶ� |
| B���ŵ�ʱΪ���������ʱΪ���� |
| C���ŵ�ʱ�����ĵ缫��ӦʽΪMHn-ne-�TM+nH+ |
| D����������ʱ����ͼ��ʵ����ʾ�Ĺ��� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
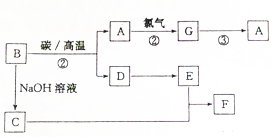 ��ͼת����ϵ�����ַ�Ӧ���������û���г����У�A�ǵؿ��еĺ���λ�ӵڶ���Ԫ����ɵĵ��ʣ�F��������ˮ�İ�ɫ������
��ͼת����ϵ�����ַ�Ӧ���������û���г����У�A�ǵؿ��еĺ���λ�ӵڶ���Ԫ����ɵĵ��ʣ�F��������ˮ�İ�ɫ�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��13�� | B��14�� |
| C��15�� | D��16�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.5mol/LHF�����ᣩ |
| B��0.5mol/L���� |
| C��0.5mol/L������ |
| D������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ѧ�� | C-H | C-F | H-F | F-F |
| ����/��kJ?mol-1�� | 414 | 489 | 565 | 155 |
| A������485 kJ |
| B������485 kJ |
| C������1940 kJ |
| D������1940 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����NaHSO4��Һ�еμ�Ba��OH��2����Һ���� SO42-+2H++Ba2++2OH-�TBaSO4��+2H2O |
| B����������������ϡ���3Fe2++4H++NO3-�T3Fe3++NO��+3H2O |
| C��NH4HCO3����������ŨKOH��Һ�У�NH4++HCO3-+2OH-=CO32-+NH3��+2 H2O |
| D����NaClO��Һ��ͨ��������CO2��CO2+2ClO-+H2O=CO32-+2HClO�� ��֪Ka1��H2CO3����Ka��HClO����Ka2��H2CO3�� �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��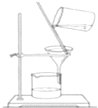 ���� |
B��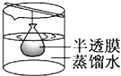 ���� |
C��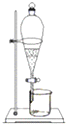 ��ȡ |
D�� �����ЧӦ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com