
【题目】一定温度下,体积一定的容器内发生可逆反应3X(g)+Y(g)![]() 4Z(g),达到平衡的标志是 ( )
4Z(g),达到平衡的标志是 ( )
A. 密度不随时间的变化
B. 3v(正,X)=v(逆,Y)
C. 单位时间内生成3n mol X,同时消耗n mol Y
D. 压强不随时间变化
科目:高中化学 来源: 题型:
【题目】C、Q、Y、Z四种元素在周期表中的相对位置如图所示,C的简单氢化物可使湿润的红色石蕊试纸变蓝。下列说法正确的是( )
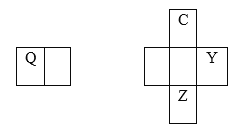
A. C只有两种氧化物
B. Q的单质在常温下可与水迅速反应
C. Y在阴暗处即可与H2剧烈反应并爆炸
D. Z的最高正价与最低负价的代数和为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年7月报道,南开大学科研团队在“可充室温钠-二氧化碳电池”的研究中取得突破进展,该电池放电时工作情况如图所示。下列说法错误的是

A. 金属Na为电池的负极
B. 放电时,电解液中Na+向碳电极移动
C. 充电时,碳电极发生的反应为:4Na++4e-+3CO2== 2Na2CO3+C
D. 放电时,每转移2 mol电子,消耗标准状况下的CO2 33.6 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
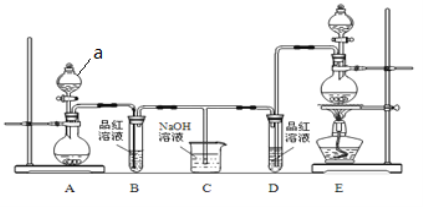
(1)仪器a的名称是____。
(2)利用图中A装置进行实验室制备SO2的化学方程式是____。
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色。停止通气后,给B、D两支试管中的液体加热,试管中现象是:B__;D___。据此,说明SO2的漂白特点是_____。
(4)装置C的作用是_______。
(5)将等物质的量的SO2和Cl2同时通入水中,所得水溶液没有漂白性的原因是(用离子方程式表示)________。要检验此时溶液中生成的负一价阴离子,方法是_____(要求答出具体实验操作、现象及结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5

(1)装置I中产生气体的化学方程式为__________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是____________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果____(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:

回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(S)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)根据上图回答下列问题

(1)P和Cl2反应生成PCl3的热化学方程式:
;
(2)PCl5分解生成PCl3和Cl2的热化学方程式:
;
温度T1时,在密闭容器中加入0.8mol PCl5 ,反应达到平衡时还剩余0.6mol PCl5 ,其分解率α1等于
(3)P和Cl2分两步反应生成1mol PCl5的△H3= ;
P和Cl2一步反应生成1mol PCl5的△H4 △H3(填“大于”,“小于”或“等于”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应H2(g)+I2(g) ![]() 2HI(g)达到化学平衡状态的标志是( )
2HI(g)达到化学平衡状态的标志是( )
A. 单位时间内生成n mol H2,同时就有n mol HI生成
B. 单位时间内有n mol H2生成,同时就有n mol I2生成
C. 容器内H2的含量不随时间的变化而变化
D. 1个H—H键断裂的同时,有2个H—I键形成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com