
A.水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kh表示),Na2CO3第一步水解反应的水解常数的表示式 Kh≤ |
B.HS-电离的离子方程式:HS-+H2O H3O++S2- H3O++S2- |
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小 |
| D.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为: |
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1 HCO3-+OH-可知,第一步水解常数Kh=
HCO3-+OH-可知,第一步水解常数Kh= ,A不正确;B、氢硫酸是二元弱酸,则HS-电离的离子方程式为HS-+H2O
,A不正确;B、氢硫酸是二元弱酸,则HS-电离的离子方程式为HS-+H2O H3O++S2-,B正确;C、合成氨反应是体积减小的放热的可逆反应,所以其他条件不变时升高温度,反应速率V(H2)增大,平衡向逆反应方向移动,则氢气的平衡转化率变小,C正确;D、燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,则根据CO(g)的燃烧热是283.0 kJ·mol-1可知,表示CO(g)的燃烧热的热化学方程式为:CO(g)+
H3O++S2-,B正确;C、合成氨反应是体积减小的放热的可逆反应,所以其他条件不变时升高温度,反应速率V(H2)增大,平衡向逆反应方向移动,则氢气的平衡转化率变小,C正确;D、燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,则根据CO(g)的燃烧热是283.0 kJ·mol-1可知,表示CO(g)的燃烧热的热化学方程式为:CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1,D正确,答案选A。
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1,D正确,答案选A。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
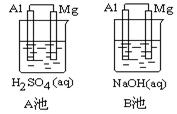
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 放电 |
| 充电 |
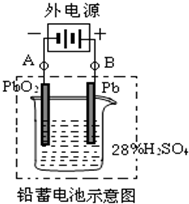
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.汽车尾气的净化反应2NO+2CO 2CO2+N2△H<0,则该反应一定能自发进行 2CO2+N2△H<0,则该反应一定能自发进行 |
| B.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
| C.由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |
D.对N2(g)+3H2(g) 2NH3(g),其他条件不变时充入N2,正逆反应速率均增大 2NH3(g),其他条件不变时充入N2,正逆反应速率均增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.对于反应2SO2(g)+O2(g)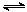 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
| B.电解法精炼铜时,精铜作阳极,粗铜作阴极 |
| C.在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) |
D.CH3COOH溶液加水稀释后,电离程度增大,溶液中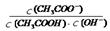 的值不变 的值不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子的核外电子排布----元素的金属性强弱 |
| B.化合物的内在结构----电解质的相对强弱 |
| C.反应温度的高低----化学平衡的移动程度 |
| D.反应物的化学性质----化学反应速率的快慢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为: OH-(aq)+H+(aq)=H2O(l) ?H =" -a" kJ·mol-1 |
| C.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
D.对于2HI(g)  H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
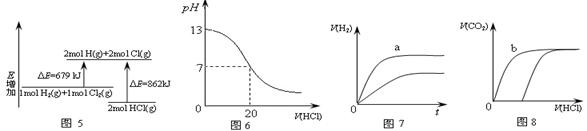
| A.图5表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H =183kJ·mol-1 |
| B.图6表示室温时用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液,溶液pH随加入酸体积变化 |
| C.图7表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
| D.图8表示10mL0.1mol/LNa2CO3和NaHCO3两种溶液中,分别滴加0.1mol/LHCl,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com