
【题目】下列装置图的使用说法正确的是
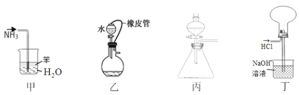
A.甲装置吸收 NH3制氨水
B.乙装置需添加其它仪器才能检验其气密性
C.丙装置中,向酸性高锰酸钾溶液中滴加草酸溶液,溶液的紫红色逐渐褪去
D.丁装置收集并吸收多余的 HCl
【答案】C
【解析】
A项、该装置没有缓冲装置,通入的氨气与水直接接触,由于氨气极易溶于水,会产生倒吸,故A错误;
B项、该装置检验气密性时,用止水夹关闭橡胶管、导气口和分液漏斗活塞,向漏斗中注入适量水后,重新塞紧漏斗口处胶塞,旋开活塞,松开导气口处止水夹,若漏斗中水不流入烧瓶,表明漏斗口处气密性良好;再关闭导气口止水夹,然后开启漏斗口处胶塞,若漏斗中水不流下,表明漏斗活塞、烧瓶口以及两根橡胶导管的连接处气密性均良好,故B错误;
C项、草酸具有还原性,高锰酸钾具有强氧化性,向酸性高锰酸钾溶液中滴加草酸溶液,酸性高锰酸钾溶液与草酸溶液发生氧化还原反应,使酸性高锰酸钾溶液的紫红色逐渐褪去,故C正确;
D项、该装置中氯化氢气体与氢氧化钠溶液直接接触,氯化氢与氢氧化钠溶液中导致气体物质的量减小,压强减小,产生倒吸,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2![]() +2e-=Mn2O3+2NH3+H2O。下列有关锌-锰干电池的叙述中,不正确的是
+2e-=Mn2O3+2NH3+H2O。下列有关锌-锰干电池的叙述中,不正确的是
A.干电池工作时,电子流动方向是由锌筒经外电路流向石墨棒
B.干电池中锌筒为负极,石墨棒为正极
C.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
D.干电池可实现化学能向电能和电能向化学能的相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关纯碱和小苏打的叙述中正确的是( )
A.Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠溶液反应
B.等质量的Na2CO3、NaHCO3分别与足量的同浓度的盐酸反应,NaHCO3消耗的盐酸比Na2CO3多
C.向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀
D.等质量的Na2CO3、NaHCO3分别与足量的稀H2SO4反应,NaHCO3产生CO2比Na2CO3多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水FeCl3呈棕红色,极易潮解, 100 ℃ 左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。

(1)装置A中反应的离子方程式为____________________________________________。
(2)装置F中所加的试剂为________。
(3)导管b的作用为________________________________________________________;
装置B的作用为__________________________________________________________。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为______________________________。
(5)为检验所得产品为FeCl3,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入____________, ___________(填试剂名称和现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用核磁共振技术测定有机物分子的三维结构的研究曾获得诺贝尔化学奖。在有机物分子中,不同位置的氢原子的核磁共振氢谱中给出的峰值(信号)也不同。根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。
例如:乙醚的结构式为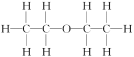 ,其核磁共振氢谱中有2个峰(信号)(参见下图)。
,其核磁共振氢谱中有2个峰(信号)(参见下图)。
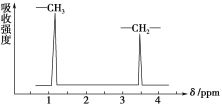
CH3CH2OCH2CH3的核磁共振氢谱
(1)下列分子中,其核磁共振氢谱中只有一种峰(信号)的物质是________。
A.CH3CH3 B.CH3COOH C.CH3COOCH3 D.CH3COCH3
(2)化合物A和B的分子式都是C2H4Br,A的核磁共振氢谱如图所示,则A的结构简式为________,请预测B的核磁共振氢谱上有________个峰(信号)。

A的核磁共振氢谱示意图
(3)用核磁共振氢谱的方法来研究C2H6O的结构,请简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为 0.1mol·L1、体积均为100mL的两种一元酸HA、HB的溶液中,分别加入固体NaOH,溶液中的lg![]() 随加入 NaOH 的物质的量的变化如图所示。下列说法正确的是
随加入 NaOH 的物质的量的变化如图所示。下列说法正确的是

A.由水电离出的 c(H+)的顺序为:c﹥a﹥b
B.b 点时酸碱恰好完全中和
C.c 点溶液中:c(B)﹥c(HB)
D.常温下电离常数:HA﹤HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G七种物质的转化关系如图所示(部分反应物、产物和反应条件未标出)。其中,A、B为中学化学常见的金属单质,C是淡黄色固体,D既能与强酸溶液反应,又能与强碱溶液反应,F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀,E和G焰色反应均呈黄色。①、④均为燃烧反应。

请回答下列问题:
(1)D的化学式____________,G的化学式____________。
(2)按要求写出下列反应的方程式:
③的化学方程式:___________________,
B与E的溶液反应的离子方程式:________________。
(3)将E的溶液逐滴加入到F的溶液中至过量,其现象是_____,总反应的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是主要大气污染物之一,工业上可用如下装置吸收转化SO2(A、B为惰性电极)。下列说法正确的是
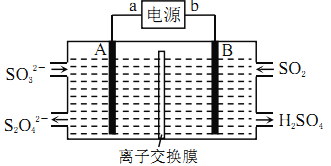
A. 电子流动方向为:B→b→a→A
B. a、A极上均发生氧化反应
C. 离子交换膜为阳离子交换膜
D. B极上的电极反应式为:SO2+2eˉ+2H2O=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或说法正确的是
A. 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
B. 已知H2(g)+F2(g)=2HF(g)△H=-270kJ·mol-1,则1molH2与1molF2反应生成2mol液态氟化氢时放热大于270kJ
C. 甲烷的标准燃烧热为△H=-890.3kJ·mol-1,则其燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1
D. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3,放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g)△H=-38.6kJ·mol-1
2NH3(g)△H=-38.6kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com