
����Ŀ�������������
��1���ؿ��к�����һ����Ԫ�ع��ɵĵ���A�뻯����B��������Ϊ232�������û���Ӧ������Ϊ��ɫ����C����һ����D������D��ˮ�����ڸ����¿ɵõ�B����
��i��д�����ɽ�������A��Ԫ�������ڱ��е�λ��Ϊ ��
��ii��д��D��ˮ������Ӧ�Ļ�ѧ����ʽ ��
��2��ij��ú��ʯ��Ԥ������SiO2��63%����Al2O3��25%����Fe2O3��5%����������þ�Ļ�����ȣ�һ���ۺ����ù���������£� 
��i������X�Ļ�ѧʽΪ �� �����ܡ�ʱ��Ӧ�����ӷ���ʽΪ ��
��ii��Ϊ�ӿ조�����ʱ�����ʣ��ɲ�ȡ�Ĵ�ʩ�����ȣ��������ּ��ɣ�
��iii����֪Fe3+��ʼ�����ͳ�����ȫ��pH�ֱ�Ϊ2.1��3.2��Al3+��ʼ�����ͳ�����ȫ��pH�ֱ�Ϊ4.1��5.4��Ϊ�˻�ø����ƷAl��OH��3 �� ��ú��ʯ�������ȡҺ��ʼ����ֻ��CaCO3һ���Լ�������������ʵ�鷽���� ��
���𰸡�
��1���������ڢ�A�壻3Fe+4H2O ![]() Fe3O4+4H2
Fe3O4+4H2
��2��CO2��Al��OH��3+OH��=AlO2��+2H2O�����������Ũ�ȣ����߷�Ӧ�¶ȡ���Сú��ʯ������С����ֽ���ȣ�����CaCO3����pH��5.4�����˵õ�����
���������⣺��1���ؿ��к�����һ����Ԫ�ع��ɵĵ���A�뻯����B��������Ϊ232�������û���Ӧ������Ϊ��ɫ����C����һ����D������D��ˮ�����ڸ����¿ɵõ�B����AΪAl��BΪFe3O4 �� CΪFe��DΪAl2O3 �� ��i��AΪAl��A��Ԫ�������ڱ��е�λ��Ϊ�������ڢ�A�壬
���Դ��ǣ��������ڢ�A�壻 ��ii��DΪFe��D��ˮ������Ӧ�Ļ�ѧ����ʽΪ3Fe+4H2O ![]() Fe3O4+4H2 ��
Fe3O4+4H2 ��
���Դ��ǣ�3Fe+4H2O ![]() Fe3O4+4H2�� ��2����SiO2��63%����Al2O3��25%����Fe2O3��5%����������þ�Ļ�������������������ķ�ӦΪ��Al2O3+6H+�T2Al3++3H2O��Fe2O3+6H+�T2Fe3++3H2O������˵���ҺΪ�Ȼ������Ȼ�������Һ����̼���������Һ�е�������ʹ���������ӡ����������Ӷ�ˮ�������������������������ij����������ټ����������ƣ�ֻҪ���������ܽⷴӦΪ��Al��OH��3+OH���TAlO2��+2H2O��������ҺΪƫ��������Һ��ͨ�������̼��һ����Ӧ������������������i���Ȼ������Ȼ���ˮ�ⶼ�������ᣬ̼��ƺ����ᷴӦ�����Ȼ��ƺͶ�����̼����������X�Ƕ�����̼����������������������Һ��Ӧ���ɿ�����ƫ�����ƣ����ӷ�Ӧ����ʽΪ��Al��OH��3+OH��=AlO2��+2H2O��
Fe3O4+4H2�� ��2����SiO2��63%����Al2O3��25%����Fe2O3��5%����������þ�Ļ�������������������ķ�ӦΪ��Al2O3+6H+�T2Al3++3H2O��Fe2O3+6H+�T2Fe3++3H2O������˵���ҺΪ�Ȼ������Ȼ�������Һ����̼���������Һ�е�������ʹ���������ӡ����������Ӷ�ˮ�������������������������ij����������ټ����������ƣ�ֻҪ���������ܽⷴӦΪ��Al��OH��3+OH���TAlO2��+2H2O��������ҺΪƫ��������Һ��ͨ�������̼��һ����Ӧ������������������i���Ȼ������Ȼ���ˮ�ⶼ�������ᣬ̼��ƺ����ᷴӦ�����Ȼ��ƺͶ�����̼����������X�Ƕ�����̼����������������������Һ��Ӧ���ɿ�����ƫ�����ƣ����ӷ�Ӧ����ʽΪ��Al��OH��3+OH��=AlO2��+2H2O��
���Դ��ǣ�CO2��Al��OH��3+OH��=AlO2��+2H2O����ii������Ӱ�췴Ӧ���ʵ����ؿ�֪��Ϊ�ӿ조�����ʱ�����ʣ��ɲ�ȡ�Ĵ�ʩ�����������Ũ�ȡ����߷�Ӧ�¶ȡ���Сú��ʯ������С����ֽ���ȣ�
���Դ��ǣ����������Ũ�ȡ����߷�Ӧ�¶ȡ���Сú��ʯ������С����ֽ���ȣ���iii��Fe3+��ʼ�����ͳ�����ȫ��pH�ֱ�Ϊ2.1��3.2��Al3+��ʼ�����ͳ�����ȫ��pH�ֱ�Ϊ4.1��5.4��Ҫʹ��������ȫ�����������Ӳ�����������Һ��PHӦ��Ϊ3.2������������������ʱ������ҺpHΪ5.4����ʹ����������ȫ������
���Դ��ǣ�����CaCO3����pH��5.4�����˵õ�������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ�Ǻ�ˮ�к����϶�Ľ���Ԫ�أ�����þ��þ�Ͻ��Լ�þ�Ļ������ڿ�ѧ�о���ҵ��������;�dz��㷺��
��1��Mg2Ni��һ�ִ���Ͻ���֪��
Mg��s��+H2��g��=MgH2��s����H1=��74.5kJmol��1
Mg2Ni��s��+2H2��g��=Mg2NiH4��s����H2=��64.4kJmol��1
Mg2Ni��s��+2MgH2��s��=2Mg��s��+Mg2NiH4��s����H3
���H3=kJmol��1
��2����ҵ�Ͽ��õ�����ڵ���ˮ�Ȼ�þ���þ�������Ȼ�þ������ˮ�ǹؼ��Ĺ���֮һ��һ������������Ȼ�þ������ˮ�ķ����ǣ��Ƚ�MgCl26H2Oת��ΪMgCl2NH4ClnNH3 �� Ȼ����700���Ѱ��õ���ˮ�Ȼ�þ���Ѱ���Ӧ�Ļ�ѧ����ʽΪ��
��3��þ��һ�ֻ���������þ[Mg��ClO3��2]����������������ݼ��ȣ�Ϊ��ȷ��ʵ�����Ʊ���Mg��ClO3��26H2O�Ĵ��ȣ����������飺
����1��ȷ����3.50g��Ʒ���100mL��Һ��
����2��ȡ10mL����ƿ�У�����10mLϡ�����20mL 1.000molL��1��FeSO4��Һ���ȣ�
����3����ȴ�����£���0.100molL��1 K2Cr2O7��Һ�ζ����յ㣬�˹����з�Ӧ�����ӷ���ʽΪ��Cr2O72��+6Fe2++14H+�T2Cr3++6Fe3++7H2O��
����4��������2��3�ظ����Σ�ƽ������K2Cr2O7��Һ15.00mL����Ʒ��Mg��ClO3��26H2O�Ĵ���Ϊ���ðٷֺű�ʾ����ȷ��С�����һλ��
��4���Զ������ѱ��渲��Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᣮ�ڲ�ͬ�¶��´����Ĵ�Ч�������������������1ͼ��ʾ��250��300��ʱ���¶����߶�������������ʽ��͵�ԭ����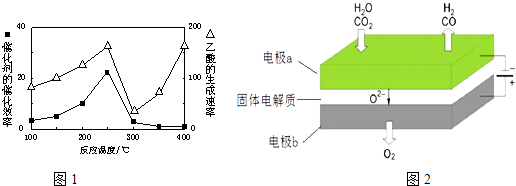
��5��Li2O��Na2O��MgO��������CO2 ��
�����Ѱ������CO2���������ʣ����н����������
a�����ڼ�����������Ѱ��
b�����ڢ�A����A��Ԫ���γɵ���������Ѱ��
c�����ھ���ǿ�����Ե�������Ѱ��
��Li2O����CO2�������ںϳ�Li4SiO4 �� Li4SiO4�������ա��ͷ�CO2 �� ԭ���ǣ���500�棬CO2��Li4SiO4�Ӵ�������Li2CO3��ƽ��������700�棬��Ӧ������У��ų�CO2 �� Li4SiO4������˵����ԭ���Ļ�ѧ����ʽ��
��6�����÷�ӦA�ɽ��ͷŵ�CO2ת��Ϊ���й�ҵ���ü�ֵ�IJ�Ʒ����ӦA��CO2+H2O ![]() CO+H2+O2���µ�⼼���ܸ�Чʵ�֣�3���з�ӦA������ԭ��ʾ��ͼ��ͼ2��CO2�ڵ缫a�ŵ�ķ�Ӧʽ�� ��
CO+H2+O2���µ�⼼���ܸ�Чʵ�֣�3���з�ӦA������ԭ��ʾ��ͼ��ͼ2��CO2�ڵ缫a�ŵ�ķ�Ӧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����MgCl2 �ڸɱ� �۱� ��Na2O2 �ݰ��ף�P4�� ����� ��Na2CO3 ����ʯ ��NaOH ��SiO2
(1)�����������������Ӿ������__________��
(2)���ڷ��Ӿ������____________��
(3)����ԭ�Ӿ������_________������ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� 2L �ݻ�������ܱ������ڣ�800��ʱ��Ӧ 2NO��g��+O2��g���T2NO2��g����ϵ�У�n��NO����ʱ��ı仯���±���
t/s | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO��/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1����O2�ķ�Ӧ���ʱ�ʾ 0��2s �ڸ÷�Ӧ��ƽ����Ӧ���� v= �� ��������Ӧ��850���½��У���Ӧ2sʱ n��NO��=0.009mol�����Ҳ�����ʱ����ı䣬��÷�Ӧ���ȷ�Ӧ��
��2��ͼ�б�ʾNO2Ũ�ȱ仯��������������ĸ���� 
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����������ţ���
A.v��NO2��=2v��O2��
B.�����ڵ�ѹǿ���ֲ���
C.v����NO��=2v����O2��
D.�����������ܶȱ��ֲ���
��4����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����������ţ���
A.��ʱ�����NO2
B.�ʵ������¶�
C.����O2��Ũ��
D.ѡ���Ч������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һЩ�����ĵ��ʡ�������֮���ת����ϵͼ����Щ��Ӧ�еIJ������ʱ���ȥ�����³�ѹ�£�AΪ��ɫ�ж����壬BΪ����ɫ��ĩ��C��EΪ�������ʣ���Ӧ�٢ھ�Ϊ��ҵ�ϵ���Ҫ��Ӧ��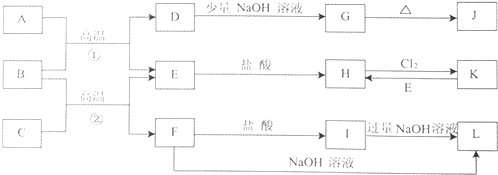
��1����Ӧ�ڵĻ�ѧ����ʽΪ ��
��2��G��J�Ļ�ѧ����ʽΪ ��
��3��K��H�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ͨ��KI��Һ��,��,�ټ���CCl4,��,����,�۲쵽��������( )
A. ���Ϻ�ɫ��������B. �γɾ��ȵ��Ϻ�ɫ��Һ
C. Һ��ֲ�,�²��Ϻ�ɫD. Һ��ֲ�,�ϲ��Ϻ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�����ʵ���Ũ�ȵ�NaOH��Һʱ�������������ҺŨ��ƫ�͵�ԭ���ǣ� ��
A.����ʱ����Һ��
B.δϴ���ձ��Ͳ�����
C.����ƿδ����
D.ת����Һǰ��Һδ��ȴ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֹ��ͪ��F������ֹ�ȡ���̵���ã��������ϳ�·�����£���֪��CH3COOH3COOC3H3+CH3Cl ![]()
![]() +HCl
+HCl 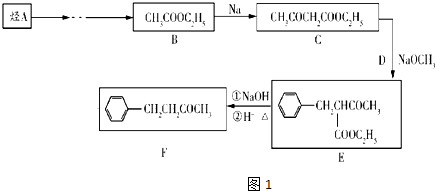
��1��E�к��еĹ���������Ϊ
��2����֪DΪ�Ȼ�����д��C+D��E�Ļ�ѧ����ʽ �� �䷴Ӧ����Ϊ
��3��1molH2�ӳɺ������л���M����������������M��ͬ���칹�����֣��ٱ��Ķ�Ԫȡ����
��1molBr2��Ũ��ˮ��ȫ������Ӧ��д����������������ȡ������֧����һ�ֽṹ ��
��4��������������Ϣ����������Ϊԭ�ϣ��ϳ�Ŀ��߷��ӻ����������ͼ��ͼ2���뽫�հ״����̲���������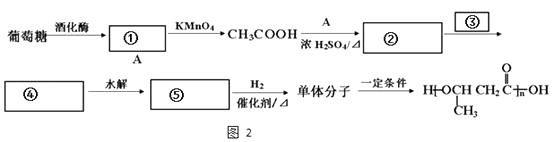
����������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com