
| A. | 铁质菜刀生锈 | B. | 燃放烟花爆竹 | C. | 食物腐败变质 | D. | 煅烧石灰石 |
分析 A、金属生锈发生了电化学腐蚀;
B、燃放烟花是剧烈的化学反应过程;
C、食物的腐败是食物缓慢氧化变质的过程;
D、煅烧石灰石是碳酸钙分解生成氧化钙和二氧化碳.
解答 解:A、铁质菜刀生锈发生了电化学腐蚀,属于化学变化过程,涉及氧化还原反应,故A错误;
B、燃放烟花是剧烈的氧化还原反应过程,故B错误;
C、食物的腐败是食物缓慢氧化变质的过程,属于氧化还原反应,故C错误;
D、煅烧石灰石是碳酸钙分解生成氧化钙和二氧化碳:CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CO2+CaO,不属于氧化还原反应,故D正确.
故选D.
点评 本题考查学生氧化还原反应的综合知识,熟悉物质的性质以及发生的反应过程是解题的关键.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:解答题
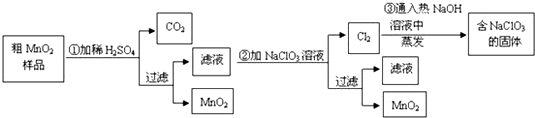
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组的同学用如图所示装置研究有关电化学的问题,当闭合该装置的电键时,观察到电流的指针发生了偏转.
某兴趣小组的同学用如图所示装置研究有关电化学的问题,当闭合该装置的电键时,观察到电流的指针发生了偏转.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发太阳能、水能、风能、地热能等新能源 | |
| B. | 大力开采煤、石油和天然气,以满足人们日益增长的能源需求 | |
| C. | 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 | |
| D. | 减少资源消耗,注重资源的重复使用、资源的循环再生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用化学反应原理解决下列问题.
利用化学反应原理解决下列问题. △H=+124kJ•mol-1
△H=+124kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3物质的量浓度:c(KNO3)=$\frac{a}{101V}$mol•L-1 | |
| B. | 20℃时KNO3的溶解度S=$\frac{100a}{b}$ g | |
| C. | KNO3质量分数:w(KNO3)=$\frac{100a}{a+b}$% | |
| D. | 该溶液的密度ρ=$\frac{1000(a+b)}{V}$g•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性锌锰干电池比普通锌锰干电池性能好,比能量和可储存时间均有提高 | |
| B. | 汽车加大油门、把食物放在冰箱里,食品包装袋内放置小包除氧剂,都是为了改变反应物转化率而采取的措施 | |
| C. | 1kg人体脂肪可存储约32 200kJ能量.一般人每行走1km 大约要消耗170kJ 能量,如果每天步行5km,一年(按365天计)中消耗的脂肪大约是9.6kg | |
| D. | 炒菜用铁锅未及时洗净(残液中含NaCl),可能发生电化学腐蚀生成红褐色锈斑 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com