
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
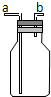 观察如图所示的装置,回答下列问题:
观察如图所示的装置,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
16 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu(OH)2与盐酸反应:H++OH-=H2O |
| B、MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ |
| C、CaCl2与Na2CO3溶液反应:Ca2++CO32-=CaCO3↓ |
| D、CaCO3与稀盐酸反应:CO32-+2H+=H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用水鉴别苯、四氯化碳、酒精三种液体 |
| B、加入足量铁屑除去FeCl2溶液中的少量FeCl3 |
| C、用激光笔照射稀豆浆,检验其是否为胶体 |
| D、配制一定物质的量浓度溶液时,容量瓶用蒸馏水洗涤后再用待装溶液润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
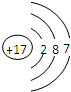 根据氯(Cl)的原子结构示意图,推测氯元素的化学性质( )
根据氯(Cl)的原子结构示意图,推测氯元素的化学性质( )| A、非常活泼,容易与钠等金属单质反应 |
| B、非常活泼,在反应中极易得到电子显+1价 |
| C、不太活泼,最高价氧化物对应的水化物为HClO |
| D、很难与其它物质发生化学反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com