
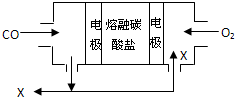
 用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )
用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )| A、X物质的化学式为CO2 |
| B、通入O2的电极为正极 |
| C、负极的电极反应式为CO+CO32--2e-=2CO2 |
| D、电池工作时,转移0.5mol电子,理论上消耗O22.8L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 可以由下列反应合成三聚氰胺:CaO+3C
可以由下列反应合成三聚氰胺:CaO+3C
| ||
| ||
 俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸 后,三聚氰酸与三聚氰胺分子相互之间通过
后,三聚氰酸与三聚氰胺分子相互之间通过查看答案和解析>>
科目:高中化学 来源: 题型:
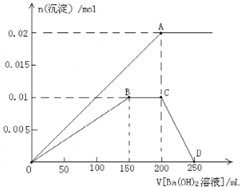 FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| 装置 | C | D |
| 实验前 | 101.0g | 56.0g |
| 实验后 | 106.4g | 69.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在NaHCO3溶液中有:C(CO32-)+C(OH-)=C(H+)+C(H2CO3) |
| B、FeCl3溶液中存在:Fe3++3H2O?Fe(OH)3+3H+ 的水解平衡,给该溶液里加少量HCl或NaOH溶液,都能使该平衡向左移动 |
| C、乙酸乙酯的制取实验中,试剂加入的顺序是:无水乙醇→浓硫酸→冰醋酸 |
| D、实验室制取甲烷的原理是:无水醋酸钠和碱石灰共热,其中碱石灰的成分是NaOH和CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 25℃平衡体系(苯、水HA) | 平衡常数 | 焓变 | 起始总浓度 |
| 在水中,HA?H++A- | K1 | △H1 | 3.0×10-3mol?L-1 |
| 在苯中,2HA?(HA)2 | K2 | △H2 | 4.0×10-3mol?L-1 |
| c[(HA)2] |
| c2(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤经过气化和液化两个物理变化,可变为清洁能源 |
| B、古代的陶瓷、砖瓦,现代的有机玻璃、水泥都是硅酸盐产品 |
| C、明矾可用于水的消毒、杀菌:碳酸钡可用于钡餐透视 |
| D、单晶硅太阳能电池板可以将太阳能直接转变为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝热剂就是单指Fe2O3粉和铝粉的混合物 |
| B、检验红砖中的红色物质是否是Fe2O3的操作步骤是:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C、分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为2:3:2 |
| D、明矾属硫酸盐,是纯净物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com