
| A、平衡常数不变 |
| B、BaO量不变 |
| C、氧气压强不变 |
| D、BaO2量增加 |


科目:高中化学 来源: 题型:
| A、铝和盐酸反应 Al+2H+=Al3++H2↑ |
| B、盐酸与氢氧化钠溶液反应 H++OH-=H2O |
| C、过量氢氧化钠溶液吸收二氧化硫 OH-+SO2=HSO3- |
| D、锌粒与稀醋酸反应生成氢气:Zn+2H+=Zn2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钡溶液与盐酸的反应 OH-+H+=H2O |
| B、澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O |
| C、铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag |
| D、碳酸钙溶于稀盐酸中 CO32-+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡前,随着反应的进行,容器内压强始终不变 |
| B、平衡时,其他条件不变,分离出硫,正反应速率加快 |
| C、平衡时,其他条件不变,升高温度可提高SO2的转化率 |
| D、其他条件不变,使用不同催化剂,该反应的平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
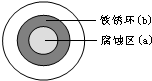 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )| A、液滴中的Cl-由a区向b区迁移 |
| B、液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-═4OH- |
| C、若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-=Cu2+ |
| D、液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在无色溶液中:NH4+、Fe2+、SO42-、CO32- |
| B、在含大量Ba2+的溶液中:Cu2+、Na+、Cl-、OH- |
| C、在强酸性溶液中:K+、Fe2+、Cl-、CH3COO- |
| D、在强碱溶液中:Na+、K+、Cl-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、消耗硝酸的物质的量为2.5mol |
| B、气体中N2O4的物质的量为0.1mol |
| C、生成NaNO3的物质的量为0.2 mol |
| D、生成的氮的氧化物的混合气倒置于水槽中,通入标准状况下8.96L O2时,气体完全被吸收 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com