
用水稀释0.1 mol?L-1氨水时,溶液中随着水量的增加而减小的是( )
A.c(OH-)/c(NH3?H2O) B.c(NH3?H2O)/c(OH-)
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
科目:高中化学 来源: 题型:
A.[H+]/[CH3COOH] B.[CH3COOH]/[H+]
C.[H+]和[OH-]的乘积 D.H+的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
用水稀释0.1 mol/L氨水时,溶液中随加水量的增加而减小的是( )
A.c(OH—)/c(NH3·H2O) B.c(NH3·H2O)/c(OH—)
C.c(H+)和c(OH—)的乘积 D.OH—的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分).A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是 ,E是 ;
(2)用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是 (填写序号)
a. b.
c.c(H+)·c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
a.反应所需要的时间E>A b.开始反应时的速率A>E
c.参加反应的锌粉物质的量A=E d.E溶液里有锌粉剩余
(4)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为___________________。
查看答案和解析>>
科目:高中化学 来源:2011届山东省日照市高三第一次模拟考试(理综)化学部分 题型:填空题
(14分)I.科学家一直致力于“人工固氮”的新方法研究。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g) ΔH=a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH=a kJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
 ”“<”或“=”)
”“<”或“=”) 2NH3 (g) ΔH=-92.4kJ·mol-1,
2NH3 (g) ΔH=-92.4kJ·mol-1, 4NH3 (g) + 3O2 (g) ΔH= ;
4NH3 (g) + 3O2 (g) ΔH= ;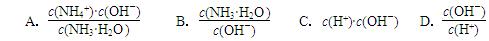
 2SO3 (g) ΔH=-196.0kJ·mol-1
2SO3 (g) ΔH=-196.0kJ·mol-1| A.加入V2O5作催化剂 | B.使用过量SO2 | C.高温 | D.通入过量空气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com