
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )。

A.X为直流电源的负极,Y为直流电源的正极
B.图中的b>a
C.阳极区pH增大
D.该过程中的产品主要为H2SO4和H2
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源:2014学年高一化学人教版必修2 1.1.3核素练习卷(解析版) 题型:填空题
有甲、乙、丙三种短周期元素,甲元素原子的质子数比中子数小2,乙元素原子核内无中子,丙元素质子数与甲元素质量数相等,且甲与丙同主族。
(1)甲、乙、丙元素的元素符号分别是________、________、________。
(2)甲与乙、丙与乙所形成的化合物稳定性强的是____________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年黑龙江省高三上学期期末考试理综化学试卷(解析版) 题型:填空题
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:

(2)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为 。
(3)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:

上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
Ⅰ.计算K1= 。
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) 。

(4)CO2经常用氢氧化钠来吸收,现有0.4 molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: 。
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在 650 ℃下工作的燃料电池,其负极反应式: 则
则
正极反应式:___ ,电池总反应式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:填空题
天然气既是重要的能源,也是重要的化工原料,其主要成分是甲烷。
(1)甲烷在一定条件下可生成:
A.碳正离子(CH3-) B.碳负离子(CH3-)
C.甲基(—CH3) D.碳烯( )
)
①四种微粒中,键角为120°的是________。(填序号)
②与碳负离子(CH3-)互为等电子体的一种分子的结构式为_________________________________________________________。
(2)海底富藏大量的可燃冰(甲烷的水合物),关于可燃冰的说法中正确的是________。
A.甲烷分子与水分子均是极性分子
B.可燃冰中甲烷分子与水分子间以氢键相结合
C.可燃冰属于原子晶体
D.甲烷分子与水分子中的σ键均是s—sp3电子云重叠而成的
(3)在高温下,甲烷可还原CuO得到Cu2O。
①Cu+的核外电子排布式为____________。
②Cu2O晶体的晶胞结构如图所示。其中“△”代表的离子符号为________。

(4)一定条件下,甲烷与水蒸气可生成H2和CO。则所生成的气体中σ键总数与π键总数之比为________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:选择题
常温下,向20 mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )。

A.a与b之间的溶液中只存在:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.b与c之间的溶液中不存在:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
C.b点时,V(NaOH溶液)=20 mL,且c(CH3COO-)=c(Na+)
D.a、b、c点表示的溶液中 均相等
均相等
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:选择题
下列有关物质的性质与应用不相对应的是( )。
A.SO2具有氧化性,可用于漂白纸浆
B.常温下,铝能被浓硝酸钝化,可用铝槽车运输浓硝酸
C.K2FeO4具有强氧化性,可用于自来水的杀菌消毒
D.Zn具有还原性和导电性,可用做锌锰干电池的负极材料
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:填空题
过硫酸钾( )具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:

(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液。写出电解时发生反应的离子方程式_____________________________________
___________________________________。
(2)已知相关物质的溶解度曲线如右图所示。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,________________,干燥。

(3)样品中过硫酸钾的含量可用碘量法进行测定。实验步骤如下:
步骤1:称取过硫酸钾样品0.300 0 g于碘量瓶中,加入30 mL水溶解。
步骤2:向溶液中加入4.00 0 g KI固体(略过量),摇匀,在暗处放置30 min。
步骤3:在碘量瓶中加入适量醋酸溶液酸化,以淀粉溶液作指示剂,用0.100 0 mol·L-1Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液21.00 mL。
(已知反应:I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将碘量瓶“在暗处放置30 min”,立即进行步骤3,则测定的结果可能________(选填“偏大”、“偏小”、“无影响”);上述步骤3中滴定终点的现象是____________________________________________。
②根据上述步骤可计算出该样品中过硫酸钾的质量分数为_______________。
③为确保实验结果的准确性,你认为还需要____________________________。
(4)将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如图所示(H+浓度未画出)。图中物质X的化学式为________________________。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:选择题
下列有关化学用语表示正确的是( )。
A.CO2的电子式: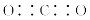
B.质子数为43、中子数为56的Tc原子:
C.Cl-的结构示意图:
D.氨基乙酸的结构简式:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:填空题
向一容积不变的密闭容器中充入一定量A和B,发生反应:xA(g)+2B(s) yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)用A的浓度变化表示该反应0~10 min内的平均反应速率v(A)=________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是________;第16 min引起曲线变化的反应条件可能是________。
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ的平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com