
| A | ①能使溴的四氯化碳溶液褪色;②比例模型为  ;③能与水在一定条件下反应生成C ;③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为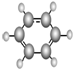 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为88的酯 |
| D | ①由C、H、O三种元素组成;②球棍模型为 |
 .
.分析 A能使溴的四氯化碳溶液褪色,含有不饱和键,结合比例模型可知A为CH2=CH2;B由C、H两种元素组成,由球棍模型模型,可知B为 ,由D的球棍模型,可知D为CH3COOH,C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,含有羟基,能与D反应生成相对分子质量为88的酯,则C为CH3CH2OH,以此解答该题.
,由D的球棍模型,可知D为CH3COOH,C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,含有羟基,能与D反应生成相对分子质量为88的酯,则C为CH3CH2OH,以此解答该题.
解答 解:(1)乙烯和水在催化作用下发生加成反应生成乙醇,方程式为CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,故答案为:CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;
(2)B是苯,苯是无色有特殊气味的液体,有毒,不溶于水,且密度小于水,与酸性高锰酸钾溶液和溴水都不反应,在一定条件下能和氢气发生加成反应生成环己烷,故答案为:②、③;
(3)在50~60℃时,苯与浓硝酸发生取代反应生成硝基苯,反应的方程式为 ,
,
故答案为:取代反应; ;
;
(4)由以上分析可知D为CH3COOH,故答案为:CH3COOH.
点评 本题考查有机物的推断,为高考常见题型和高频考点,侧重考查学的分析能力,题目涉及有机物结构与性质,注意根据结构模型推断有机物,注意掌握官能团的性质与转化是关键,旨在考查学生对基础知识的掌握,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | SiO2是一种酸性氧化物,能够与水反应生成相应的酸 | |
| B. | 光导纤维的主要成分是硅 | |
| C. | 实验室保存氢氧化钠溶液不能用玻璃塞 | |
| D. | 晶体硅具有金属光泽,可以导电,因此晶体硅属于金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 苯乙醇属于芳香醇,它与邻甲基苯酚互为同系物 | |
| B. | 1 mol CPAE最多可与含4 mol Br2的水溶液发生反应 | |
| C. | 用FeCl3溶液可以检测上述反应中是否有CPAE生成 | |
| D. | 咖啡酸、苯乙醇及CPAE都能发生取代、加成和消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 230Th和232Th是钍的两种同素异形体 | |
| B. | H2与T2互为同素异形体 | |
| C. | 乙酸乙酯与丁酸互为同分异构体 | |
| D. | 甲醇与甲醚互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质$\stackrel{+O_{2}}{→}$ 氧化物 $\stackrel{+H_{2}O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐,能按照上述转化关系直接转化的可以是硫元素 | |
| B. | 某无色溶液中加入Ba(NO3)2溶液,再加入盐酸,沉淀不溶解,则原溶液中一定有SO42- | |
| C. | 浓硫酸有强氧化性,常温下能与Cu发生剧烈反应 | |
| D. | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com