


���� ����������������գ��õ���ɫ�̼�������ף������ʵ���=$\frac{2.24L}{22.4L/mol}$=0.1mol�������Һ����������Ʒ�Ӧ������Һ�ף�����Ԫ���غ�֪����Һ���ǿ��������Σ���Һ�����ᷴӦ���ɰ�ɫ������Ȼ���ɫ�����ܺ�ϡ���ᷴӦ������Һ�������ΪNaAlO2����ɫ��������Al��OH��3����Һ����AlCl3��
�����Һ�������������Һ��Ӧ��������ɫ���壬ΪCu��OH��2������������ͭ�õ���ɫ�����ΪCuO��n��CuO��=$\frac{4.0g}{80g/mol}$=0.05mol����ɫ��������յõ���ɫ���嶡����������Cu��Cu2O�����������Ԫ���غ�֪�����к���Cu��O��AlԪ�أ���n��Cu��=n��CuO��=0.05mol������Ԫ���غ��Ҽ�������Ԫ�أ����Լ��к���Cu��Al��SԪ�أ�n��Al��=$\frac{7.75g-0.05mol��64g/mol-0.1mol��32g/mol}{27g/mol}$=0.05mol�������Cu��Al��Sԭ�Ӹ���֮��=0.05mol��0.05mol��0.1mol=1��1��2�����Լ�ΪCuAlS2��
��1����ɫ�������н���Ԫ�ص������������ӣ�������ԭ�Ӻ�����2�����Ӳ㡢������������8���ݴ���д�����ӽṹʾ��ͼ��
��2���������Ϸ���֪�������������O2�б������ɶ���������������CuO��
��3����Һ����ƫ�����ƺ��������ƣ���Һ����ͨ�����CO2����̼�����ơ�����������
��4���������CuO�����嶡��Cu��Cu2O�������������ԭ���ɶ�������������Ӧ�þ��л�ԭ�ԣ�
��5��Cu��ϡ�����Ӧ��Cu2O��ϡ���ᷴӦ��������ͭ��Cu�����Ը��ݷ�Ӧǰ�����������Դ�Сȷ������ɷ֣�
Cu��CO����Ӧ��Cu2O��CO��Ӧ����Cu�Ͷ�����̼�����ݷ�Ӧǰ�����������Դ�Сȷ������ɷ֣����Ը�������ʵ��ȷ�����ɷ֣�
��� �⣺����������������գ��õ���ɫ�̼�������ף������ʵ���=$\frac{2.24L}{22.4L/mol}$=0.1mol�������Һ����������Ʒ�Ӧ������Һ�ף�����Ԫ���غ�֪����Һ���ǿ��������Σ���Һ�����ᷴӦ���ɰ�ɫ������Ȼ���ɫ�����ܺ�ϡ���ᷴӦ������Һ�������ΪNaAlO2����ɫ��������Al��OH��3����Һ����AlCl3��
�����Һ�������������Һ��Ӧ��������ɫ���壬ΪCu��OH��2������������ͭ�õ���ɫ�����ΪCuO��n��CuO��=$\frac{4.0g}{80g/mol}$=0.05mol����ɫ��������յõ���ɫ���嶡����������Cu��Cu2O�����������Ԫ���غ�֪�����к���Cu��O��AlԪ�أ���n��Cu��=n��CuO��=0.05mol������Ԫ���غ��Ҽ�������Ԫ�أ����Լ��к���Cu��Al��SԪ�أ�n��Al��=$\frac{7.75g-0.05mol��64g/mol-0.1mol��32g/mol}{27g/mol}$=0.05mol�������Cu��Al��Sԭ�Ӹ���֮��=0.05mol��0.05mol��0.1mol=1��1��2�����Լ�ΪCuAlS2��
��1����ɫ�������н���Ԫ�ص������������ӣ�������ԭ�Ӻ�����2�����Ӳ㡢������������8���������ӽṹʾ��ͼΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2���������Ϸ���֪�������������O2�б������ɶ���������������CuO����Ӧ����ʽΪ4AlCuS2+13O2$\frac{\underline{\;\;��\;\;}}{\;}$2Al2O3+4CuO+8SO2��
�ʴ�Ϊ��4AlCuS2+13O2$\frac{\underline{\;\;��\;\;}}{\;}$2Al2O3+4CuO+8SO2��
��3����Һ����ƫ�����ƺ��������ƣ���Һ����ͨ�����CO2����̼�����ơ��������������ӷ���ʽΪCO2+OH-=HCO3-��CO2+2H2O+AlO2-=Al��OH��3��+HCO3-��
�ʴ�Ϊ��CO2+OH-=HCO3-��CO2+2H2O+AlO2-=Al��OH��3��+HCO3-��
��4���������CuO�����嶡��Cu��Cu2O�������������ԭ���ɶ�������������Ӧ�þ��л�ԭ�ԣ�
CO��CH3CH2OH��Al���ܻ�ԭ�����ɶ��������û�л�ԭ�ԣ���ѡD��
��5��ͨ�����Ϸ���֪���ù��������Cu��Cu2O�������
Cu��ϡ�����Ӧ��Cu2O��ϡ���ᷴӦ��������ͭ��Cu�����Ը��ݷ�Ӧǰ�����������Դ�Сȷ������ɷ֣�
Cu��CO����Ӧ��Cu2O��CO��Ӧ����Cu�Ͷ�����̼�����ݷ�Ӧǰ�����������Դ�Сȷ������ɷ֣����Ը�������ʵ��ȷ�����ɷ֣�
��������鷽��Ϊ��
����һ��ȡ��ɫ���嶡mg������ϡ�������ˡ�ϴ�ӡ����������أ�������������Ϊng�����m=n��ΪCu����m=$\frac{9n}{4}$����ΪCu2O����n��m��$\frac{9n}{4}$����Ϊ������
��������ȡ��ɫ���嶡mg��ͨ������CO���������أ�������������Ϊng����m=n����ΪCu����m=$\frac{9}{8}$n����ΪCu2O����n��m��$\frac{9}{8}$n����Ϊ������
�ʴ�Ϊ��Cu��Cu2O�������
����һ��ȡ��ɫ���嶡mg������ϡ�������ˡ�ϴ�ӡ����������أ�������������Ϊng�����m=n��ΪCu����m=$\frac{9n}{4}$����ΪCu2O����n��m��$\frac{9n}{4}$����Ϊ������
��������ȡ��ɫ���嶡mg��ͨ������CO���������أ�������������Ϊng����m=n����ΪCu����m=$\frac{9}{8}$n����ΪCu2O����n��m��$\frac{9}{8}$n����Ϊ������
���� ���⿼�����ʳɷ�ȷ����Ϊ��Ƶ���㣬���ؿ���ѧ�������ƶ���������ȷ������ɫ�������ǽⱾ��ؼ����ѵ���ʵ�鷽����ƣ�Ҫ�����������ʽ��ʵ��Ŀ��ȷ��ʵ����ƣ�ͬʱ����ѧ��˼ά�����ԡ�ʵ�������ʵ�������������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ˮ�õ����Ӧ�ļ� | B�� | ����Ӧ��ˮ�����ǿ�������ǿ�� | ||
| C�� | ����ǿ����Һ��Ӧֻ�����κ�ˮ | D�� | ���ǽ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH3+HCl�TNH4Cl | B�� | H2S+Na2S�T2NaHS | ||
| C�� | 2CO+O2$\frac{\underline{\;��ȼ\;}}{\;}$2CO2 | D�� | CO2+NaOH�TNaHCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | A��B�γɵĻ�����Ϊ���������� | |
| B�� | �����Ӱ뾶��D��B��C | |
| C�� | ��������Ԫ���е�����������ɵ���������ˮ���ɴٽ�ˮ�ĵ��� | |
| D�� | ��ͬ������C��D���ʷֱ���������ϡ���ᷴӦ��ǰ�����ɵ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧ�� | C-C | C-H | H-H | C-O | C��O | H-O |
| ����/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
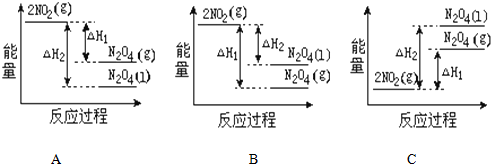
 ��1��1.00g CH4��ȫȼ������Һ̬ˮ��CO2���ų�55.6kJ������д����ʾCH4��ȼ���ȵ��Ȼ�ѧ����ʽCH4��g��+2O2��g���TCO2��g��+2H2O��l����H=-889.6KJ•mol-1��
��1��1.00g CH4��ȫȼ������Һ̬ˮ��CO2���ų�55.6kJ������д����ʾCH4��ȼ���ȵ��Ȼ�ѧ����ʽCH4��g��+2O2��g���TCO2��g��+2H2O��l����H=-889.6KJ•mol-1���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaHCO3��Һ�ĵ��룺NaHCO3�TNa++HCO3- | |
| B�� | �Ȼ����Һ��ˮ�⣺NH4++H2O�TNH3•H2O+H+ | |
| C�� | ̼���Ƶ�ˮ�⣺CO32-+2H2O�TH2CO3+2OH- | |
| D�� | �Ȼ�����̼������Һ��ϣ�2Al3++3CO32-+3H2O�T2Al��OH��3��+3CO2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com