
【题目】下表是元素周期表的一部分,用相关化学用语回答下列问题:
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | A | B | C | D | ||||
3 | E | F | G | H | I | J | K | L |
(1)写出H、I两种元素的名称_____________、_____________。
(2)这些元素的气态氢化物中最稳定的是________________,元素A的最高价氧化物的分子式为____________,属于______________化合物(填离子或共价);
其电子式为_______________;其结构式为_______________。
(3)从E到K的元素中,______原子半径最小。元素E和J形成的化合物属于_______化合物(填离子或共价)
(4)试用实验证明E和F的金属性的强弱(简述实验内容和结论)_____________________________________________________________________________________________。
【答案】 硅 磷 HF CO2 共价 ![]() O=C=O Cl 离子 钠和冷水剧烈反应,镁和冷水微弱反应,钠的金属性强于镁(合理即可)
O=C=O Cl 离子 钠和冷水剧烈反应,镁和冷水微弱反应,钠的金属性强于镁(合理即可)
【解析】本题分析:本题主要考查元素的性质。
(1)H、I两种元素的名称是硅、磷。
(2)这些元素的气态氢化物中最稳定的是非金属性最强的氟形成的HF。元素A是碳,碳的最高价氧化物的分子式为CO2,属于共价化合物,其电子式为![]() ,其结构式为
,其结构式为
O=C=O。
(3)从E到K的元素中,同周期元素从左到右原子半径渐小,Cl原子半径最小。元素E和J形成的化合物硫化钠属于离子化合物。
(4)金属性的强弱可以通过金属与水或酸反应置换出氢的难易程度来推断。钠和冷水剧烈反应,镁和冷水微弱反应,钠的金属性强于镁。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的
是( )
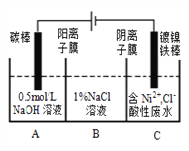
已知:放电顺序:Ni2+(高浓度)>H+> Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O
B. 为了提高Ni的产率,电解过程中需要控制废水pH
C. 电解过程中,B中NaCl溶液的物质的量浓度将不断增大
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式不会发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为A1203,还含有Fe203、Si02)提取氧化铝,冶炼铝的原料,提取的操作过程如下:
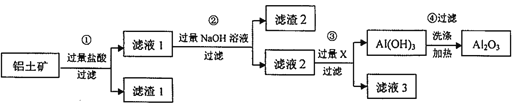
请回答下列问题:
(1)写出步骤①中发生反应的离子方程式_______;滤渣①的成分为________。
(2)写出步骤②中生成含铝化合物的化学方程式__________________;能否将此步骤中的NaOH 溶液更换为氨水?_________(填“能”或“不能”)。若不能,请说明理由:_________(若能,则此空不答)。
(3)步骤③中的X 为______(填化学式),发生反应的离子方程式为_______。
(4)若铝土矿的质量为mkg,最后得到A12O3的质量为nkg(忽略提取过程中铝元素的损失),则铝土矿中铝元素的质量分数为_____________(用含m、n 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下:
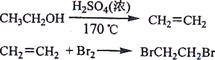
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l 40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
1)、A元素是 ;B元素是 ;C元素是 (用元素符号表示)。
2)、D是由两种元素组成的双原子分子,其分子式是 。
3)、E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 。
4)、F是由两种元素组成的三原子分子,其分子式是 ,电子式是 。
5)G分子中含有4个原子,其分子式是 。
6)、H分子中含有8个原子,其分子式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯可在金属锡、盐酸作用下生成氯化苯铵盐(![]() )、氯化亚锡(SnCl2)和水。
)、氯化亚锡(SnCl2)和水。
(1)己知锡位于第五周期,与C同主族,写出Sn2+的最外层电子排布式_______;Cl-中有___个填充电子的能级。
(2)画出硝基的电子式______,氯化亚锡分子的空间构型是________;氯化苯胺盐(![]() )中N原子的杂化方式为_____,该盐的水溶度较苯胺大的原因是___________。
)中N原子的杂化方式为_____,该盐的水溶度较苯胺大的原因是___________。
(3)在上述反应中的各物质涉及的微粒间作用力有_______。
A、共价键 B、金属键 C、离子键 D、配位键 E、氢键 F、范德华力
(4)Sn的一种同素异形体——灰锡的晶体结构类似金刚石,立方晶胞结构如图所示,则锡的配位数是_______。
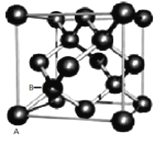
(5)假设锡原子(如图中A、B两原子)在体对角线上外切,晶胞参数为a,计算灰锡的空间利用率约为________。(百分数表示,取两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2+O2![]() 2SO3达到平衡的标志是( )
2SO3达到平衡的标志是( )
①消耗2molSO2的同时生成2molSO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
④恒容条件下压强保持不变
⑤一定体积下气体的密度保持不变
⑥v正(SO2)=2v逆(O2)
A.①②⑤ B.①③④ C.③④ D③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com