
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是 ( )
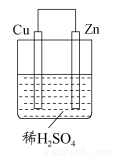

A.①②③ B.②④C.④⑤⑥ D.③④⑤
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
T°C时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。
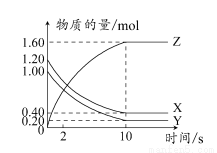
下列描述正确的是( )
A.平衡时,X、Y的转化率相同
B.达到平衡后,将容器体积压缩为1 L,平衡向正反应方向移动
C.T°C时,该反应的化学方程式为:X(g)+Y(g) 2Z(g),平衡常数K=40
2Z(g),平衡常数K=40
D.T°C时,若起始时X为0.71 mol,Y为1.00 mol,则平衡时Y的转化率约为60%
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:选择题
下列关于催化剂的说法不正确的是( )
A.温度越高,催化剂的催化效果越好
B.汽车排气管上的“催化转化器”能减少有害气体排放
C.催化剂可以改变化学反应速率,但反应前后质量和化学性质不变
D.锌与盐酸反应时,加入几滴硫酸铜溶液可加快反应速率,但硫酸铜不作催化剂
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-2 原电池、常见的化学电源练习卷(解析版) 题型:填空题
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的开关K时,观察到电流计的指针发生了偏转。
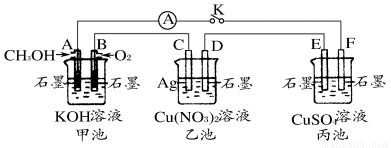
请回答下列问题:
(1)甲、乙、丙三池中为原电池的是__________(填“甲池”、“乙池”或“丙池”)。
(2)丙池中F电极为__________(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应式为__________。
(3)当乙池中C电极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为__________mL(标准状况)。
(4)一段时间后, 断开开关K。下列物质能使丙池恢复到反应前浓度的是__________(填选项字母)。
A.Cu B.CuO C.CuCO3 D.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-2 原电池、常见的化学电源练习卷(解析版) 题型:选择题
实验发现,298 K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。下列有关说法中正确的是( )
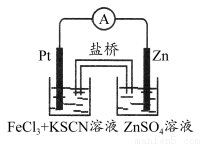
A.该原电池的正极反应是:Zn-2e-=Zn2+
B.左烧杯中溶液的红色逐渐褪去
C.该电池铂电极上有气泡出现
D.该电池总反应为:3Zn+2Fe3+=2Fe+3Zn2+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:选择题
已知某反应A(g)+B(g) C(g)+D(g),过程中的能量变化如图所示,回答下列问题。
C(g)+D(g),过程中的能量变化如图所示,回答下列问题。
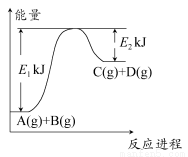
(1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________ kJ·mol-1(用含E1,E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH________(填“增大”“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同
C.已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-a kJ·mol-1,②2H2(g)+O2(g)=2H2O(l) ΔH=-b kJ·mol-1,则a>b
D.已知:①C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.0 kJ·mol-1,则C(s,石墨)=C(s,金刚石) ΔH=+1.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:选择题
X、Y、Z分别是三种常见的金属或非金属单质, M、N、R是常见的三种氧化物。其中一种具有高熔点,而且有如下反应(条件未标出,方程未配平):(1)X+Z→N;(2)M+X→N;(3)M+Y→R+X 。若X是非金属,则组成Y单质的元素在周期表中的位置是( )
A.第二周期ⅣA族 B.第三周期ⅡA族
C.第二周期Ⅵ A族 D.第三周期ⅣA族
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-2 铁、铜的获取和应用练习卷(解析版) 题型:填空题
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为______________________________;
(2)过程Ⅰ加入铁屑的主要作用是________,分离得到固体的主要成分是______________,从固体中分离出铜需采用的方法是________________;
(3)过程Ⅱ中发生反应的化学方程式为______________;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为________。(列式计算)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com