
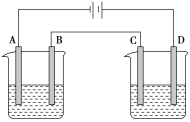
【题目】按图进行电解实验(A、B、C、D均为惰性电极),可供选择的电解质溶液列于下表中。要求满足的条件是:
①工作一段时间后甲中溶液的pH上升,乙中溶液的pH下降;
②B、C两极上放电的离子的物质的量相等。
甲 乙
组别 | ① | ② | ③ | ④ |
甲烧杯 | NaOH溶液 | NaCl溶液 | H2SO4溶液 | AgNO3溶液 |
乙烧杯 | CuSO4溶液 | AgNO3溶液 | AgNO3溶液 | CuCl2溶液 |
(1)应选择的电解质溶液是________组。
(2)电极反应式:B极______________________;D极___________________________。
(3)当B极上析出3.55g电解产物时,C极将析出______(填物质名称)的质量为______g。
【答案】2 2Cl--2e-=Cl2↑ 4OH--4e-=O2↑+2H2O 银 10.8
【解析】
(1)①甲槽是电解水,氢氧化钠溶液pH増大, b电板是阳极,电极反应为:4OH--4e-=2H2O+O2↑;乙槽电解硫酸铜溶液,溶液pH減小,c电极为阴极,电解反应为: Cu2++ 2e- = Cu,依据电子守恒可知,b、c两极上反应的离子的物质的量不相等,①不符合;
②甲槽是电解氯化钾,氯化钾溶液pH增大,b电极是阳极,电极反应为:4OH--4e-=2H2O+O2↑;乙槽电解硝酸银溶液,溶液pH减小,c电极为阴极,电解反应为:4Ag++ 4e- = 4Ag,依据电子守恒可知,b、c两极.上反应的离子的物质的量相等,符合题意,②符合;
③甲槽是电解水,硫酸溶液pH減小,b电极是阳极,电极反应为:4OH--4e-=2H2O+O2↑;乙槽电解硝酸银溶液,溶液pH減小,c电极为阴极,电解反应为:4Ag++ 4e- = 4Ag,依据电子守恒可知,b、c两极上反应的离子的物质的量相等,③不符合;
④甲槽是电解硝酸银,溶液pH減小,b电极是阳极,电极反应为:4OH--4e-=2H2O+O2↑;乙槽电解氯化铜溶液,溶液pH減小,c电极为阴极,电解反应为: Cu2++ 2e- = Cu,依据电子守恒可知,b、c两极上反应的离子的物质的量不相等,④不符合;
答案为: ②;
(2)根据(1)的分析,各个电极反应式如下:
A极: 2H++2e-= H2↑;
B极:2Cl--2e-=Cl2↑;
C极:4Ag++ 4e- = 4Ag;
D极:4OH--4e-=2H2O+O2↑;
故答案为:2Cl--2e-=Cl2↑;4OH--4e-=2H2O+O2↑;
(3)B极:2Cl--2e-=Cl2↑,当B极上析出3.55g氯气即0.05mol电解产物时,转移电子是0.1mol,此时C极:4Ag++ 4e- = 4Ag,C极将析出0.1molAg,质量是10.8g。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在2 L的恒容容器中,充入1 mol A和3 mol B,并在一定条件下发生如下反应:A(s)+3B(g)![]() 2C(g),若经3 s后测得C的浓度为0.6 mol·L-1,下列选项说法正确的组合是( )
2C(g),若经3 s后测得C的浓度为0.6 mol·L-1,下列选项说法正确的组合是( )
①用B表示的反应速率为0.4 mol·L-1·s-1
②3 s时生成C的物质的量为1.2 mol
③3 s时B的浓度为0.6 mol·L-1
A. ①②B. ①③
C. ②③D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示原电池工作时,右池中Y2O72-转化为Y3+。下列叙述正确的是( )
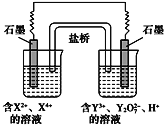
A.左池中阴离子数目增加
B.每消耗1 mol Y2O72-,转移3 mol电子
C.改变右池溶液的c(H+),电流强度不变
D.左池电极反应式:X4++2e-=X2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碳酸钠、碳酸氢钠的说法正确的是

A.25℃时,碳酸氢钠在水中的溶解度比碳酸钠大
B.可用澄清石灰水鉴别碳酸钠溶液和碳酸氢钠溶液
C.可用如图所示装置比较Na2CO3和 NaHCO3的热稳定性
D.常温下,浓度均为0.1mol·L![]() 时的pH:NaHCO3 > Na2CO3
时的pH:NaHCO3 > Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁单质及化合物与我们的生产、生活紧密相关。
(1)Fe3+的基态核外价电子排布式为_____,应用原子结构比较 Fe 与同周期的 Mn 第三电离能(I3)的大小:I3(Mn)______I3(Fe)(填>、<、=)。理由是______。
(2)Fe、Fe2+、Fe3+可以与 CO、SCN-、CN-、H2NCONH2(尿素)等多种配体形成很多的配合物。
①配合物 Fe(CO)5 的熔点-20℃,沸点 103℃,可用于制备纯铁。Fe(CO)5 的结构如图所示。下列关于 Fe(CO)5 说法不正确的是____。
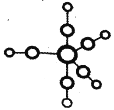
A.Fe(CO)5 是分子晶体
B.Fe(CO)5 中 Fe 原子的配体与C22-互为等电子体
C.Fe(CO)5 中 σ 键与 π 键之比为 1:1
D.Fe(CO)5=Fe+5CO 反应中没有新化学键生成
②CN-的电子式为_____。
③H2NCONH2(尿素)中 N、C 原子的杂化方式分别为_____、______,组成尿素的 4 种元素的第一电离能由大到小的顺序为_____,1 mol H2NCONH2(尿素) 分子中含有 σ 键的数目为_____。
(3)NaCl 和MgO 都属于离子化合物,NaCl 的熔点为 801.3 ℃,MgO 的熔点高达 2800℃。造成两种晶体熔点差距的主要原因是_____。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7 属正交晶系(长方体形)。晶胞参数为 a pm、b pm、c pm。如图为沿 y 轴投影的晶胞中所有 Cs 原子的分布图和原子分数坐标。据此推断该晶胞中Cs 原子的数目为_____。
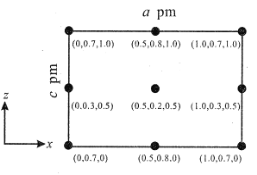
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D均为烃的衍生物,它们之间的转化关系如下图所示:

A俗称酒精;B是甲醛的同系物;C的分子式为C2H4O2。完成下列填空:
(1)A的结构简式为_________________;C的结构简式为_________________。
(2)下列能用来检验B的试剂为________________。(双选)
a.新制Cu(OH)2 b.银氨溶液 c.紫色石蕊试液
(3)D的名称为_______________;A与C反应生成D的反应类型为_______________。
(4)D与CH3CH2CH2COOH互为_______________。
a.同系物 b.同分异构体 c.同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由二氧化碳制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________________。
(2)反应Ⅲ能够自发进行的条件是_______________ (填“较低温度” “较高温度”或“任何温度” )。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是______。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是__________。
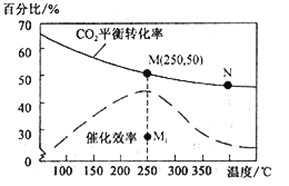
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250 ℃时,随温度升高甲醇的产率增大
C.M 点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)已知下列物质在20℃下的Ksp如下,试回答下列问题:
编号 | ① | ② | ③ | ④ | ⑤ |
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 1.8×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 2.0×10-12 |
①20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是(填编号)____________。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时c(Br-)/c(Cl-)=________________。
③ 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是____。
A.KBr B.KI C.K2S D.K2CrO4
(6)已知25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。
①在25℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成______________沉淀(填化学式)。
②溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中___________(填“还含有”或“不含有”)Al(OH)3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物分子结构简式如图所示,下列关于该物质的说法不正确的是( )
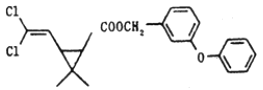
A.分子式为C21H20O3Cl2B.醚键上的氧原子至少与另外11个原子共面
C.该有机物最多与6molH2加成D.在一定条件下可发生加成、取代、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是

A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com