
| A. | Fe可以和S在加热条件下生成Fe2S3 | |
| B. | Cl2和H2S相遇可发生反应:H2S+Cl2═2HCl+S↓ | |
| C. | 在酸性溶液中,Fe3+和S2-可以大量共存 | |
| D. | Cl2可以氧化Fe3+ |
分析 已知氧化性强弱顺序:Cl2>Br2>Fe3+>I2,氧化性强的离子与还原性强的离子能发生氧化还原反应,据此分析.
解答 解:A、已知氧化性:Fe3+>S,则Fe3+能氧化S2-,Fe可以和S在加热条件下生成FeS,故A错误;
B、根据H2S+Cl2═2HCl+S↓可知氧化性是Cl2>S,符合题干已知条件,所以化学方程式成立,故B正确;
C、已知氧化性:Fe3+>S,则Fe3+能氧化S2-,所以在酸性溶液中Fe3+和S2-不大量共存,故C错误;
D已知氧化性:Cl2>Fe3+,则Cl2能氧化Fe2+生成Fe3+,但是Cl2不能氧化Fe3+,故D错误;
故选B.
点评 本题考查了氧化还原反应,侧重于氧化性强弱的判断方法的考查,注意根据题干中氧化性顺序判断,题目难度不大.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③①④②⑤ | B. | ①③⑤④② | C. | ③②①⑤④ | D. | ⑤②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | Cl2O | C. | ClO2 | D. | Cl2O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质的导电能力可能弱于弱电解质 | |
| B. | 二氧化碳的水溶液能够导电,因此二氧化碳是电解质 | |
| C. | 金属氧化物都是碱性氧化物 | |
| D. | 胶体和溶液的本质区别是丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
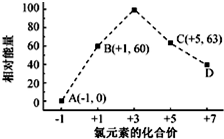 元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.
元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.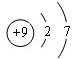 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com