
 常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )
常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )| A. | 欲使NaHA溶液里中性,可以向其中加入酸或碱 | |
| B. | 向NaHA溶液加入水的过程中,pH可能增大也可能减小 | |
| C. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
分析 A、NaHA溶液显示酸性,若使溶液显示中性,需要向溶液中进入碱溶液,不能加入酸;
B、根据图象可知,NaHA溶液显示酸性,向NaHA溶液加人水的过程中,其电离程度增大,但是溶液中氢离子浓度减小,溶液的pH一定增大;
C、根据图象知,当V(NaOH)=20时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,电离为主,溶液显酸性;
D、等体积等浓度的NaOH溶液与H2A溶液混合后,溶质为NaHA,根据图象可知c(A2-)>c(H2A),溶液显示酸性,然后根据溶液中酸或碱抑制水电离,含有弱根离子的盐水解促进水电离进行判断.
解答 解:A、由图示关系知,NaHA溶液中c(A2-)>c(H2A),溶液显示酸性,如果使溶液呈中性,应该向溶液中加入碱溶液,不能加入酸溶液,故A错误;
B、NaHA溶液加人水的过程中,HA-电离程度增大,但是溶液中氢离子浓度减小,溶液的pH增大,故B错误;
C、当V(NaOH)=20 mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,HA-电离大于水解,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故C正确;
D、等体积等浓度的NaOH溶液与H2A溶液混合后,由图示关系知,c(A2-)>c(H2A),说明电离大于水解程度,c(H+)>c(OH-),溶液显酸性,溶液中氢离子抑制了水的电离,溶液中水的电离程度比纯水小,故D错误;
故选C.
点评 本题考查酸碱混合溶液定性判断、溶液中离子浓度大小比较,题目难度中等,试题侧重于学生的分析能力的考查,为高考常见题型,明确图象中酸碱混合时溶液中的溶质成分是解答本题的关键,抓住图象进行分析即可.


科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | Ⅵ | VⅡA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
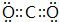 ,写出它的一种用途做灭火剂等.
,写出它的一种用途做灭火剂等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3)3CCH2CH3 | ||
| C. | (CH3)2CHCH2CH2CH(CH3)2 | D. | (CH3)2CHCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是酸性溶液 | B. | 一定是碱性溶液 | ||
| C. | 可能是中性溶液 | D. | 可能是酸性溶液也可能是碱性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| B. | 24Cr原子的电子排布式是1s22s22p63s23p63d44s2 | |
| C. | 所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 | |
| D. | 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是吸热反应 | B. | 是放热反应 | C. | 是熵减少的反应 | D. | 是熵增大的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com