
����Ŀ��ij�о�С��������ͼװ��̽��CO��ԭFe2O3���õ���һ�ֺ�ɫ��ĩ�ijɷ�(�̶�װ����ȥ��������֪��Fe2������K3[Fe(CN)6]��Һ������ɫ����)
��ش����}��
��1�����������������ӿڴ����ҵ�����˳��Ϊ:
i������g��h������j �� k�� ����������ĸ��ţ�
��2��֤��Fe2O3������ԭ����������
��3���о�С��Ժ�ɫ��ĩ�ijɷ�������в��룺
������һ����ɫ��ĩ�ijɷֿ�����Fe��
�����������ɫ��ĩ�ijɷֿ�����FeO��
������������ɫ��ĩ�ijɷֿ�������
��Ʋ����ʵ������:
���� | ���� | ���� |
�� | ����ϡ���� | �ܽ⣬������ |
�� | ȡ����1����Һ���μ�K3[Fe(CN)6]��Һ | ��ɫ���� |
�� | ��� |
�ٸ���ʵ�����������������
���о�С��������3����Һ�еμ�������ˮ��������Һ��ɫ��ȥ�����ܵ�ԭ����֤����Ϊ��
��4������װ�û��в���֮�����Ľ���ʩΪ��
���𰸡�
��1��c��d��a��b��f��e
��2��F�еĹ����ɺ���ɫ���ɫ��C����Һ����ǡ�
��3��Fe3O4��ȡ����1����Һ���μ�KSCN��Һ����������SCN����Cl2����������Һ�м���KSCN��Һ�������ֺ�ɫ,�������������������𰸾��ɵ÷֣�
��4��������װ�õ�β�����ڴ�������һȼ�ŵľƾ��ƣ����õ��ܽ�β������C���ƾ��Ƶ�ȼ�������������𰸾��ɵ÷֣�
��������(1) ��CO��ԭFe2O3 �� �������װ�ã�������̼���������ȷֽ����ɶ�����̼��ͨ��Ũ����������̼��Ӧ����CO����ͨ����ʯ�ҳ�ȥδ��Ӧ�Ķ�����̼���������Ʒ��Ӧ�����ɵĶ�����̼�ó�ȥ�ij����ʯ��ʯ���顣���������������ӿڴ����ҵ�����˳��Ϊ:i��c��d��g��h��a��b��j �� k��f��e�����Դ��ǣ�c��d ��a��b��f ��e��
(2)֤��Fe2O3�ѱ���ԭ��������F�еĹ����ɺ���ɫ���ɫ��C����Һ����ǣ����Դ��ǣ�F�еĹ����ɺ���ɫ���ɫ��C����Һ����ǣ�(3)���ݷ�Ӧ��õ��ĺ�ɫ��ĩ����ɫ����ɫ��ĩ�ijɷֿ�����Fe��FeO��Fe3O4 �� ���Դ��ǣ�Fe3O4��
(3)����ʵ��Ŀ�ģ���Ҫ���������ܽ�����Һ���Ƿ���������Ӻ��������ӣ���˲���3Ϊȡ����1����Һ���μ�KSCN��Һ�����Դ��ǣ�ȡ����1����Һ���μ�KSCN��Һ���ٸ���ʵ��������1����Һ���μ�K3[Fe(CN)6]��Һ��������ɫ������˵�������������ӣ���Һ��죬֤�����������ӣ�˵�����������������Դ��ǣ��������о�С��������3����Һ�еμ�������ˮ��������Һ��ɫ��ȥ�����ܵ�ԭ����SCN����Cl2����������Һ�м���KSCN��Һ�������ֺ�ɫ,�������������Դ��ǣ�����SCN����Cl2����������Һ�м���KSCN��Һ�������ֺ�ɫ,����������
(4)β���к���һ������CO������Ⱦ�������Ľ���ʩΪ������װ�õ�β�����ڴ�������һȼ�ŵľƾ��ƣ����Դ��ǣ�������װ�õ�β�����ڴ�������һȼ�ŵľƾ��ơ�
�����㾫����������Ĺؼ��������⻯ѧʵ��������Ⱥ�˳������֪ʶ�����ջ�ѧʵ��˳����ѭ�����������ϡ�ԭ�������ҡ�ԭ���ȡ���������ԭ�������ȷš�ԭ��Һ���ӡ�ԭ�����������ԣ�װ��ҩƷǰ���У�ԭ���ƾ��ƣ�����װ����Ϻ��ٵ�ƾ��ƣ�ԭ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������VSEPRģ���ƶϷ��ӻ����ӵ����幹�͡�
CS2;
AlBr3(���۷���)��
�������ֻ��Է�Ӧ�м�����,���ǵ����о�����1��̼ԭ�Ӻ�3����ԭ�ӡ�����������������������������ģ��,д����Ӧ�Ļ�ѧʽ: ;
; ��
��
�۰�Ҫ��д���ڶ����ڷǽ���Ԫ�ع��ɵ����Է��ӵĻ�ѧʽ��
ƽ���η���,�����η���,�������η�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֻ�ѧ���ʺܻ��õķǽ������ʣ������н�ǿ�������ԡ����������в���ȷ���ǣ��� ��
A.���ȵ�ͭ˿�������о���ȼ�գ������ػ�ɫ��
B.����������ȼ�գ����ɰ�ɫ����
C.�����������������а�����ȼ�գ��ڼ���ƿ���γɰ�ɫ����
D.��������ˮ��Ӧ��������ʹ����ᣬ����������ֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������˳����ȷ���ǣ� ��
�����ȶ��ԣ�H2O��HF��H2S ��ԭ�Ӱ뾶��Na��Mg��O
�����ԣ�H3PO4��H2SO4��HClO4 �ܽ������������OH-��CH3COO-��Cl-
A���٢�B���ڢ�C���٢�D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�����ת��������һ����Ӧʵ�ֵ��ǣ� ��
A. �������ơ��������� B. ������Ȼ���
C. ������������ D. ����þ��������þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����϶���������HEV����ʹ���������أ��乤��ԭ����ͼ��ʾ�� ����MΪ����Ͻ�MHΪ��������ԭ�ӵĴ���Ͻ�KOH��Һ�����Һ�����������أ�����˵������ȷ���ǣ� ��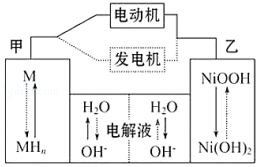
A.���ʱ����������pH����
B.�綯������ʱ��Һ��OH������ƶ�
C.�ŵ�ʱ������ӦʽΪ��NiOOH+H2O+e���TNi��OH��2+OH��
D.�缫�ܷ�ӦʽΪ��MH+NiOOH ![]() M+Ni��OH��2
M+Ni��OH��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ�к�����ᵼ�����ж���ˮ�����ܽ������Ҫ��As�����������κ�As��������������ʽ���ڣ�
��1��������Ϊͬһ����Ԫ�أ���ԭ�ӽṹʾ��ͼΪ ��
��2������Ԫ�������ɣ�����˵����ȷ���� �� a�����ԣ�H2SO4��H3PO4��H3AsO4
b��ԭ�Ӱ뾶��S��P��As
c���ǽ����ԣ�S��P��As
��3�����ڵ���ˮ�������Դ�ж��ּ��裬����һ����Ϊ�Ǹ�����Ļ�����FeS2��������ΪFe��OH��3 �� ͬʱ����SO42�� �� �������������������ˮ��FeS2��O2���������ӷ���ʽΪ ��
��4��ȥ��ˮ���е��飬���Ƚ�As����ת��ΪAs��������ѡ��NaClO��ʵ�ָ�ת�����о�NaClOͶ������As���������ʵ�Ӱ��õ����½���� 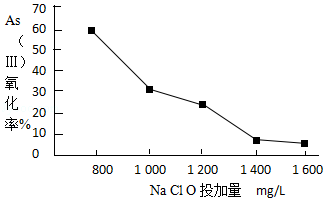
��֪��Ͷ��ǰˮ��pH=5.81��0.1mol/LNaClO��ҺpH=10.5����Һ�����������õ������Ǵ����ᣮ�����˽����ԭ���� ��
��5��ǿ�����ӽ�����������������������̬���ڵ�As�������ﵽȥ��As��Ŀ�ģ� ��֪��һ�������£�As�������Ĵ�����ʽ�����ʾ��
pH | ��2 | 2��7 | 7��11 | 11��14 |
������ʽ | H3AsO4 | H2AsO3�� | HAsO42�� | HAsO42����AsO43�� |
pH=6ʱ��NaClO���������ᣨH3AsO3�������ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ӦCH3OH��l��+NH3��g��CH3NH2��g��+H2O��g���ڸ��¶�ʱ�����Է����У���÷�Ӧ���̵ġ�H����S�ж���ȷ���ǣ� ��
A.��H��0����S��0
B.��H��0����S��0
C.��H��0����S��0
D.��H��0����S��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���������ȡ��������
A. ѹե������ȡ��֬ B. �ͺ�ˮ�ķ���
C. ��CCl4��ȡˮ���ܽ��I2 D. ��ȥ�����е�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com