
| A. | 硫原子的原子结构示意图: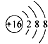 | |
| B. | NH4Cl的电子式: | |
| C. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm为不同的核素,有不同的化学性质 | |
| D. | 在固态水中,水分子间以氢键结合成排列规整的晶体,在这种晶体中有空隙,造成体积膨胀,密度减小至低于水的密度 |
分析 A.硫原子的原子结构是核外电子数和核内质子数相等;
B.应标出氯离子周围的电子;
C.同种元素的原子化学性质相同;
D.在固态水中,水分子间以氢键结合成排列规整的晶体.
解答 解:A.硫原子的原子结构示意图是: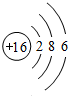 ,故A错误;
,故A错误;
B.氯化铵的电子式为: ,故B错误;
,故B错误;
C.${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm为同位素,化学性质相同,故C错误;
D.在固态水中,水分子间以氢键结合成排列规整的晶体,晶体中有空隙,密度减小至低于水的密度,故D正确.
故选D.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,涉及原子结构示意图、电子式、同位素、氢键等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的分析能力及规范答题能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据燃烧产物中元素的种类可以确定有机化合物中所含元素的种类 | |
| B. | 利用质谱仪记录的质谱图可以精确测定该有机化合物的相对分子质量 | |
| C. | 利用红外光谱仪记录的红外光谱图可以初步推测有机化合物中官能团类别 | |
| D. | 利用核磁共振仪记录的核磁共振氢图可以确定该有机化合物中氢原子的类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔点、沸点随核电荷数的增加而增大 | |
| C. | 它们的气态氢化物的热稳定性随核电荷数的增加而减小 | |
| D. | 它们的气态氢化物的还原性随核电荷数的增加而减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.
电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑤ | C. | ①③⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,溶液pH变化如图1所示.
用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,溶液pH变化如图1所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com