
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)《本草纲目》曾记载利尿剂甘汞(Hg2Cl2)制法:“用水银一两,白矾[KAl(SO4)212H2O]二两,食盐一两,同研,不见星。铺于器内,以小乌盆覆之,筛灶灰,盐水和,封固盘口,以炭打二柱香取开,则粉升于盆上矣,其白如雪,轻盈可爱,一两汞可升粉八钱。”
①KAl(SO4)212H2O所属物质类别为___________ (填标号)。
A.硫酸盐 B.酸式盐 C.正盐 D.电解质
②文中“则粉升于盆上矣”涉及的分离方法是___________。
③甘汞(Hg2Cl2)制备反应中,还原剂与氧化剂的物质的量之比为_______,该反应中还原产物是_______。
④由甘汞(Hg2Cl2)光照可得外科用药升汞(HgCl2),该反应化学方程式为_________。
(2)H2O2、酸性KMnO4在生产、生活、医疗卫生中常用作消毒剂,高锰酸钾造成的污渍可用草酸 (H2C2O4 )去除,完成下列问题。
①对于下列涉及H2O2的反应,H2O2仅体现氧化性的反应是_____(填标号,下同),H2O2既体现氧化性又体现还原性的反应是_______。
A.Ag2O+H2O2=2Ag+O2↑+H2O
B.2H2O2=2H2O+O2↑
C.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
②酸性高锰酸钾与草酸反应,氧化产物与还原产物的物质的量之比为___________。
③在稀硫酸中,KMnO4和H2O2反应的离子方程式为_________。
【答案】ACD 升华 4:1 SO2 Hg2Cl2![]() Hg+HgCl2 C B 5:1 2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
Hg+HgCl2 C B 5:1 2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
【解析】
(1) ①KAl(SO4)212H2O在水中电离方程式为KAl(SO4)212H2O=K++Al3++2SO42-+12H2O,因而KAl(SO4)212H2O属于硫酸盐、正盐和电解质,故选ACD;
②“则粉升于盆上矣”说明固体变成了气体,涉及的分离方法是升华;
③由已知结合氧化还原反应原理,制取甘汞时,KAl(SO4)2作氧化剂,汞作还原剂,化学方程式表示为4KAl(SO4)2 + 6Hg + 6NaCl ![]() 3Hg2Cl2 + 3Na2SO4 + 2K2SO4 + 2Al2O3 + 3SO2↑,由化学方程式可得:若6molHg与8mol SO42-反应,生成3molSO2,则只有3mol SO42-被还原,故还原剂和氧化剂的物质的量之比为:
3Hg2Cl2 + 3Na2SO4 + 2K2SO4 + 2Al2O3 + 3SO2↑,由化学方程式可得:若6molHg与8mol SO42-反应,生成3molSO2,则只有3mol SO42-被还原,故还原剂和氧化剂的物质的量之比为:![]() ;氧化剂发生还原反应,生成还原产物,故该反应中还原产物是SO2;
;氧化剂发生还原反应,生成还原产物,故该反应中还原产物是SO2;
④甘汞(Hg2Cl2)光照可得外科用药升汞(HgCl2),汞元素的化合价由+1升高为+2,因为Cl元素的化合价为最低价态,所以甘汞分解还会生成Hg,故化学方程式为:Hg2Cl2![]() Hg+HgCl2。
Hg+HgCl2。
(2) ①A.Ag2O+H2O2=2Ag+O2↑+H2O中Ag元素化合价由+1价变为0,O元素化合价由-1价变为0,结合元素化合价升降总数相等,O元素化合价不可能从-1降至-2,故H2O2为还原剂;
B.2H2O2=2H2O+O2↑中只有O元素化合价发生变化,O元素化合价由-1价升至0,同时O元素化合价由-1价降至-2,故H2O2为氧化剂和还原剂;
C.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O中同时O元素化合价由-1价降至-2,故H2O2为氧化剂;
故H2O2仅体现氧化性的反应是C,H2O2既体现氧化性又体现还原性的反应是B;
②酸性高锰酸钾与草酸反应的方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,Mn元素化合价由+7变为+2,C元素化合价由+3变为+4,故氧化产物为CO2,还原产物为MnSO4,氧化产物与还原产物的物质的量之比为![]() ;
;
③在稀硫酸中,KMnO4和H2O2反应时,MnO4-作氧化剂,对应还原产物为Mn2+,H2O2作还原剂,对应氧化产物为O2,结合缺项配平的原理可知离子方程式为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】下列实验的反应原理及对应的离子方程式均正确的是( )
A.室温下测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++H2ONH3H2O+H+
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH﹣═2AlO2﹣+H2↑
C.Na2CO3溶液呈碱性的原因:![]()
D.用酸性高锰酸钾标准溶液滴定草酸:2MnO4﹣+16H++5C2O42﹣═2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学在实验室研究Al与CuCl2溶液的反应.
实验操作 | 实验现象 |
|
|
(1)现象![]() 中的红色物质是 ______ .
中的红色物质是 ______ .
(2)经检验现象![]() 中的无色气体为氢气.
中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因 ______.
②氢气从红色物质表面逸出的原因是 ______ .
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液![]()
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是 ______.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因 ______.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有 ______性.
②取Cu粉与1mol/LCuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)具有强氧化性,受热易分解,可作漂白剂、食品消毒剂等。
Ⅰ.亚氯酸钠的制备
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
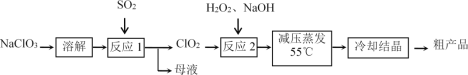
(1)“反应1”中的氧化剂是_____(填化学式,下同),母液中溶质的主要成分是_____。
(2)每有1mol SO2参加反应,理论上可生成ClO2的物质的量为________mol。
(3)如果将SO2换为Na2SO3和稀H2SO4,则“反应1”的离子方程式为________。
(4)“反应2”使用H2O2而不使用其他物质的主要理由是____________________。
Ⅱ.亚氯酸钠的应用
(5)用亚氯酸钠作水处理剂,水中可能残留少量亚氯酸钠,可以加入硫酸亚铁除去残留的亚氯酸盐,硫酸亚铁除可与亚氯酸钠反应外,还可以起到的作用是____________。
(6)实验室可用亚氯酸钠和氯酸钠在酸性条件下反应制备ClO2气体。
①上述反应的离子方程式为____________。
②ClO2也可用于杀菌消毒,其消毒能力是等物质的量Cl2的_______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(X)与溶液中沉淀物的量(Y)的关系示意图中正确的是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3ySO3zH2O),为测定某碱式硫酸铁的组成,取5.130g样品溶于足量盐酸中,然后加入过量的BaCl2溶液,经过滤、洗涤、干燥得白色固体5.825g,向上述滤液中加入过量的NaOH溶液,经过滤、洗涤、灼烧得到固体1.600g,该样品的化学式为( )
A.Fe2O32SO37H2OB.4Fe2O310SO325H2O
C.3Fe2O36SO320H2OD.2Fe2O35SO317H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.FeCl2溶液中通入Cl2:![]()
B.Ba(OH)2溶液与盐酸的反应:![]()
C.Al(OH)3沉淀中滴加盐酸:![]()
D.AlCl3溶液中加入过量氨水:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,3D-SiC@2D-MoS2异质接面催化剂具有优异的光催化CO2用纯水的全还原性能,有效实现电子/空穴的定向迁移,最终实现CO2和H2O在相应活性位点发生氧化还原反应,如图所示。下列叙述错误的是( )

A.2D-MoS2是H2O氧化的催化剂
B.H+和e-容易在SiC@MoS2催化剂间进行反应
C.中间产物的转化“HCOOH→HCHO→CH3OH”均发生还原反应
D.总反应的方程式为CO2(g)+2H2O(g)![]() CH4(g)+2O2(g)
CH4(g)+2O2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、F是家庭中常见的有机物,A和B碳原子数相等,E是石油化工发展水平的标志,F是一种常见的高分子材料。下面是几种物质的转化关系图:
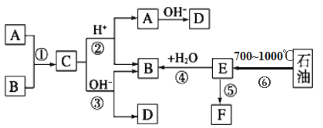
完成下列填空:
(1)操作⑥的名称为:_____________________________________,上述反应中属于取代反应的是___________(填序号)
(2)写出比B多两个碳原子,且不能发生非燃烧性氧化反应的同系物的结构简式:___。
(3)写出反应③所用的碱液为氢氧化钠溶液,写出反应③的化学方程式____________。
(4)写出F的名称________________________,反应⑤的反应类型为_________。
(5)写出检验B的催化氧化产物的化学方程式____________,实验现象是______。
(6)写出两个既能发生银镜反应又能发生酯化反应的C的同分异构体结构简式。
________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com