
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的PH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |


科目:高中化学 来源: 题型:
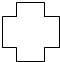 某环烷烃的结构像红十字会的会徽,因此有人称它为“红十字烷”结构如图,其分子式为
某环烷烃的结构像红十字会的会徽,因此有人称它为“红十字烷”结构如图,其分子式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 举例反应 | mA(g)+nB(g)?pC(g)+qD(g) | 平衡是否建立 | ||||
| 混合物体系中各成分的含量 | ①各物质的物质的量或各物质的物质的量分数一定 | |||||
| ②各物质的质量或各物质的质量分数一定 | ||||||
| ③各气体的体积或体积分数一定 | ||||||
| ④总压强、总体积、总物质的量一定(m+n和p+q的关系不定) | ||||||
| 正、逆反应速率的关系 | ①在单位时间内消耗了m molA同时生成m molA | |||||
| ②在单位时间内消耗了n molB同时生成p molC | ||||||
| ③vA:vB:vC:vD=m:n:p:q | ||||||
| ④在单位时间内生成了n molB,同时消耗q molD | ||||||
| 压强 | ①m+n≠p+q时,总压力一定(其他条件一定) | |||||
| ②m+n=p+q时,总压力一定(其他条件一定) | ||||||
混合气的平均相对分子量
| ①
| |||||
②
| ||||||
| 温度 | 在其他条件不变的条件下,体系温度一定时 | |||||
| 体系的密度 | 密度一定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
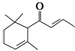 分子式为C13H20O,有关该化合物的下列说法正确的是( )
分子式为C13H20O,有关该化合物的下列说法正确的是( )| A、一定条件下1mol该化合物最多可与2mol氢气加成 |
| B、该化合物可发生银镜反应 |
| C、1mol该化合物完全燃烧消耗19mol O2 |
| D、该化合物可发生加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、互称为同分异构体的物质不可能具有相同的通式 |
| B、通式相同的不同有机物一定属于同系物 |
| C、互为同分异构体的物质之间物理性质一定不同,但化学性质一定相似 |
| D、具有相同官能团的有机物不一定是同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com