
| 168g |
| 56g/mol |
| 6mol×3mol |
| 3mol |


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
| A、同浓度的下列溶液中:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,c(NH4+)由大到小的顺序是:②>③>① |
| B、常温时,将等体积的盐酸和氨水混合后,当pH=7时,则c(NH4+)>c(Cl-) |
| C、0.1mol?L-1Na2CO3溶液中:c(OH-)=c(NH4+)+c(H+)+c(H2CO3) |
| D、0.1 mol?L-1的NH4Cl溶液与0.05mol?L-1NaOH溶液等体积混合溶液显碱性:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O | ||||
B、用铜为电极电解饱和食盐水:2Cl-+2H2O
| ||||
| C、硫酸亚铁溶液被空气中氧气氧化:4Fe2++O2+2H2O=4Fe3++4OH- | ||||
| D、小苏打溶液中加少量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、混合液中,[H+]=
| ||
| B、混合液的pH=7 | ||
| C、混合液中,c ( B+)=c ( A - )+c ( OH -) | ||
| D、a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
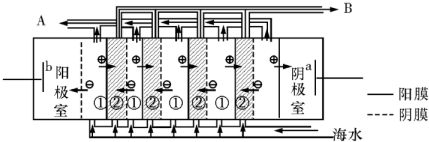
查看答案和解析>>
科目:高中化学 来源: 题型:
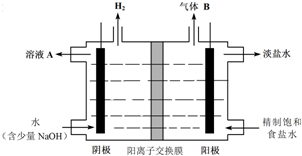
查看答案和解析>>
科目:高中化学 来源: 题型:
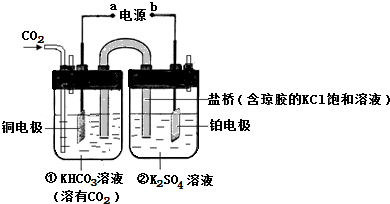
| A、该过程是电能转化为化学能的过程 |
| B、一段时间后,①池中n(KHCO3)不变 |
| C、一段时间后,②池中溶液的pH一定下降 |
| D、铜电极的电极反应式为CO2+8H++8e-═CH4+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com