
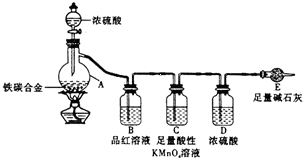
 某学习小组设计了图示实验装置(省略了夹持仪器)来测定某铁碳合金中铁的质量分数.
某学习小组设计了图示实验装置(省略了夹持仪器)来测定某铁碳合金中铁的质量分数.分析 由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)常温下碳与浓硫酸不反应,铁在浓硫酸中发生钝化现象;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水;
(3)A中生成的气体含有CO2、2SO2,SO2具有漂白性,能使品红溶液褪色;二氧化硫存在会影响二氧化碳的质量测定,C装置的作用为除尽反应产物中的SO2气体;
(4)装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小,如果碱石灰吸收了空气中的二氧化碳和水,则导致测量的二氧化碳的质量偏大,即合金中碳元素的质量偏大;
(5)称取w g铁碳合金,加入足量浓硫酸反应生成硫酸铁,加入足量的NaOH溶液,过滤洗涤干燥,灼烧至恒重,称量得到氧化铁的质量ag,结合元素守恒和质量分数定义计算;洗涤应该在过滤装置中进行;检查是否洗净,需要用到的试剂是氯化钡溶液检验是否含有硫酸根离子;
(6)①依据滴定管使用方法和基本操作回答;
②溶液中可能同时有+3价和+2价的铁,无法计量,甲基橙变色范围是3.1--4.4属于酸性溶液,可能溶解沉淀.
解答 解:由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)常温下,铁与浓硫酸反应生成一层致密的氧化物保护膜,阻止内金属继续与浓硫酸反应,发生钝化现象,
故答案为:常温下Fe遇浓硫酸发生钝化;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水,反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)A中生成的气体含有CO2、2SO2,SO2具有漂白性,能使品红溶液褪色;C装置的作用为除尽反应产物中的SO2气体,防止影响二氧化碳的质量测定,
故答案为:品红溶液褪色;除尽反应产物中的SO2气体;
(4)装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小,铁元素的质量偏大,质量分数偏大,也可能偏小是因为空气中的CO2和水被碱石灰吸收,则导致测量的二氧化碳的质量偏大,即合金中碳元素的质量偏大,铁元素的质量偏小,质量分数偏小;
故答案为:装置内的CO2难以被E完全吸收;空气中的CO2和水被碱石灰吸收;
(5)称取w g铁碳合金,加入足量浓硫酸反应生成硫酸铁,加入足量的NaOH溶液,过滤洗涤干燥,灼烧至恒重,称量得到氧化铁的质量ag,结合元素守恒和质量分数定义计算;洗涤应该在过滤装置中进行;检查是否洗净,需要用到的试剂是氯化钡溶液检验是否含有硫酸根离子;
合金中铁的质量分数=$\frac{\frac{ag}{160g/mol}×2×56g}{wg}$×100%=$\frac{70a}{w}$%;
故答案为:过滤、灼烧;BaCl2溶液;$\frac{70a}{w}$;
(6)①把标准盐酸注入润洗过的红色手柄滴定管后,应该打开活塞,尖嘴部分充满溶液并排出气泡,并使液面位于零刻度或零刻度以下位置,记录读数;
故答案为:尖嘴部分充满溶液并排出气泡;
②该方法即使操作规范,也有很大的误差,属于“方法错误”的理由是:因为溶液中可能同时有+3价和+2价的铁,无法计量;不能用甲基橙,因为酸性环境,可能造成沉淀溶解;
故答案为:因为溶液中可能同时有+3价和+2价的铁,无法计量,不能用甲基橙,因为酸性环境,可能造成沉淀溶解.
点评 本题考查了物质组成的分析判断,实验探究方法,滴定实验故分析应用,注意计算方法和基本操作的理解应用,掌握基础是关键,题目难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2中混有少量SO3,通过足量浓硫酸,收集气体 | |
| B. | HNO3溶液中混有少量H2SO4,加入适量BaCl2溶液,再过滤 | |
| C. | 提取溴水中的溴,可用加入乙醇萃取的方法 | |
| D. | 检验溶液中是否含有Fe2+,向溶液中滴入氯水后,再滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c( S2O82-)/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正丁烷和异丁烷的一氯取代物都只有两种,它们的沸点也相同 | |
| B. | 乙烯分子与苯分子都能与H2发生加成反应,说明二者均含碳碳双键 | |
| C. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 | |
| D. | 乙醛加入Cu(OH)2粉末并加热可看到红色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com