
| A. | 2mol•L-1 | B. | 0.5mol•L-1 | C. | 1mol•L-1 | D. | 3mol•L-1 |
分析 反应后溶液中再加入氢氧化钠溶液,要使产生的沉淀的质量最大,则沉淀为氢氧化镁与氢氧化铝,此时溶液为氯化钠溶液,根据钠离子与氯离子守恒计算氢氧化钠的物质的量,进而计算氧化钠溶液的浓度.
解答 解:要使产生的沉淀的质量最大,则沉淀为氢氧化镁与氢氧化铝,此时溶液为氯化钠溶液,根据钠离子与氯离子守恒可知:n(NaOH)=n(NaCl)=n(HCl)=0.5L×4mol/L=2mol,所以需氢氧化钠溶液的物质的量浓度为$\frac{2mol}{1L}$=2mol/L,
故选:A.
点评 本题考查化学方程式有关计算,明确酸碱恰好中和时沉淀质量最大及氢氧化铝能溶于强碱时解答本题的关键,注意利用守恒法计算解答.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2+2NaOH═Na2SO3+H2O | |
| B. | SiH4+2H2O+8AgNO3═8Ag↓+SiO2↓+8HNO3 | |
| C. | Na2O+H2O═2NaOH | |
| D. | Al(OH)3+NaOH═Na[Al(OH)4] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
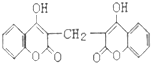 化学家从腐败草料中提取出双香豆素,结构简式如图.1mol双香豆素与NaOH溶液反应,最多可消耗NaOH的物质的量是( )
化学家从腐败草料中提取出双香豆素,结构简式如图.1mol双香豆素与NaOH溶液反应,最多可消耗NaOH的物质的量是( )| A. | 4 mol | B. | 5mol | C. | 6 mol | D. | 8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量Mg(OH)2固体可溶于较浓的NH4Cl溶液中:Mg(OH)2+2NH4+═Mg2++2NH3•H2O | |
| B. | 在CuSO4溶液中加入PbS,可转变为铜蓝(CuS):Cu2++PbS═Pb2++CuS | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| D. | 向Na2S2O3溶液中滴加稀硫酸,溶液变混浊:S2O32-+2H+═S↓+SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验室采用图①所示装置收集SO2 | |
| B. | 用图②所示装置,分离CCl4萃取I2水后的有机层和水层 | |
| C. | 除去NaHCO3溶液中的Na2CO3可加入Ca(OH)2溶液后过滤 | |
| D. | 称取0.40gNaOH,放入100mL容量瓶中,配制0.10mol•L-1的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
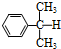 )氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下:
)氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下: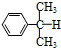 +O→
+O→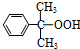 (异丙苯过氧氢)
(异丙苯过氧氢)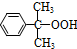 $→_{50-60℃}^{H+}$
$→_{50-60℃}^{H+}$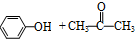 (丙嗣)
(丙嗣)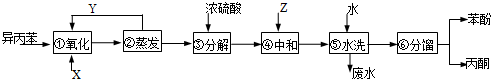
| 物质 | 丙酮 | 苯酚 | 异丙苯 |
| 密度(g/mL) | 0.7898 | 1.0722 | 0.8640 |
| 沸点/°C | 56.5 | 182 | 153 |
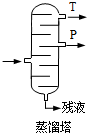 ,产品T是丙酮,
,产品T是丙酮, ;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.
;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com