
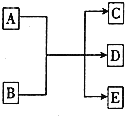
 ��һ�������£�����A��E��ת����ϵ��ͼ��ʾ������AΪ���ʣ�������EΪ��ɫҺ�壮
��һ�������£�����A��E��ת����ϵ��ͼ��ʾ������AΪ���ʣ�������EΪ��ɫҺ�壮���� ��1����A��C��D������Ԫ�أ�CΪ�ȼҵ��ԭ�ϣ�ӦΪNaCl��D��Һ����Ư���ԣ�ӦΪNaClO����A��B�ķ�ӦΪ������NaOH�ķ�Ӧ��
��2����AΪ��ɫ������ӦΪͭ��BΪij���Ũ��Һ��D���γ��������ɫ���壬ӦΪSO2����BΪŨ���
��3�������������ɫ���п����ԣ�����ʱ�ָܻ���ԭ������ɫ����NaClO��Ư���Բ����森
��� �⣺��1����A��C��D������Ԫ�أ�CΪ�ȼҵ��ԭ�ϣ�ӦΪNaCl��D��Һ����Ư���ԣ�ӦΪNaClO����A��B�ķ�ӦΪ������NaOH�ķ�Ӧ��
��Ӧ�Ļ�ѧ����ʽΪCl2+2NaOH=NaCl+NaClO+H2O������ǿ������ClO-����ʹKI������Һ����ɫ��˵������I2����Ӧ�����ӷ���ʽΪ2I-+ClO-+H2O=I2+Cl-+2OH-������Cl-��
������AgCl������ˮ����������ʣ�������ȡ��������Һ���Թ��У���������ϡ�����ữ���ٵ���AgNO3��Һ����������ɫ��������֤����Cl-��
�ʴ�Ϊ��Cl2+2NaOH=NaCl+NaClO+H2O��2I-+ClO-+H2O=I2+Cl-+2OH-��ȡ��������Һ���Թ��У���������ϡ�����ữ���ٵ���AgNO3��Һ����������ɫ��������֤����Cl-��
��2����AΪ��ɫ������ӦΪͭ��BΪij���Ũ��Һ��D���γ��������ɫ���壬ӦΪSO2����BΪŨ���ᣬ��Ӧ�Ļ�ѧ����ʽΪCu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O��
amol Cu��ȫ��Ӧ����amolSO2����NaOH��Ӧ������NaHSO3��Na2SO3��������NaOH�����ʵ����ķ�Χ��a mol��n��NaOH����2a mol��
�ʴ�Ϊ��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O��a mol��n��NaOH����2a mol��
��3�������������ɫ���п����ԣ�����ʱ�ָܻ���ԭ������ɫ����NaClO��Ư���Բ����棬��ȡ������ɫ�����Һ���ȣ�����Һ�ָ���ɫ������SO2ʹƷ����ɫ������Һ����죬����NaClOʹƷ����ɫ��
�ʴ�Ϊ��ȡ������ɫ�����Һ���ȣ�����Һ�ָ���ɫ������SO2ʹƷ����ɫ������Һ����죬����NaClOʹƷ����ɫ��
���� ���⿼��������ƶϣ���Ŀ�ѶȽϴ���ע����ݳ���Ԫ�ػ���������ʽ����ƶϣ����ñ��⣬������ʵ�Ļ���֪ʶ�ǹؼ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ${\;}_{53}^{135}$I�ǵ��һ��ͬ�������� | |
| B�� | ${\;}_{53}^{135}$I��һ���·��ֵ�Ԫ�� | |
| C�� | ������������53 | |
| D�� | ���ڵ�����������������֮��Ϊ29 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ķ��ȴ���ͼ���Ķ��ȴ�����Ŀ��ͬ | |
| B�� | �����һ�ȴ�����3�� | |
| C�� | �������ȴ�����3�� | |
| D�� | C5H12��ͬ���칹����4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ӵı���ģ�ͣ� | B�� | ����ı���ģ�ͣ� | ||
| C�� | CH2Cl2��CH4O��C2H4O2һ���Ǵ����� | D�� | ��ϩ�Ľṹʽ��CH2�TCH2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
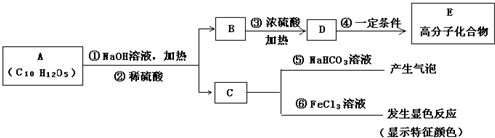

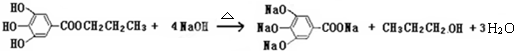
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
�� +NaHCO3��
+NaHCO3�� +H2O+CO2����
+H2O+CO2�����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com