
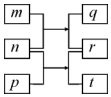
 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r为一元强酸,t通常是固态单质.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r为一元强酸,t通常是固态单质.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W>X>Y | B. | 元素的非金属性Z>X>Y | ||
| C. | X的氢化物常温常压下为液态 | D. | Y的最高价氧化物的水化物为弱酸 |
分析 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,则n为Cl2,Z为Cl,氯气与p在光照条件下生成r与s,r为一元酸,则r为HCl,t通常是固态单质,p为H2S,氯气与m反应生成HCl与q,q的水溶液具有漂白性,则m为H2O,q为HClO,结合原子序数可知W为H元素,X为O元素,Y为S元素,结合元素周期律解答.
解答 解:由上述分析可知,W为H,X为O,Y为S,Z为Cl,
A.电子层越多,原子半径越大,则原子半径的大小W<X<Y,故A错误;
B.同主族从上到下非金属性减弱,同周期从左向右非金属性增强,其O只有负价,则元素的非金属性X>Z>Y,故B错误;
C.X的氢化物为水或过氧化物,常温常压下为液态,故C正确;
D.Y的最高价氧化物的水化物为硫酸,为强酸,故D错误;
故选C.
点评 本题考查无机物的推断及原子结构和周期律,为高频考点,把握n为氯气及T为S为推断物质的突破口,侧重分析与推断能力的考查,注意元素化合物性质及规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 一定属于分解反应 | B. | 一定属于氧化还原反应 | ||
| C. | 一定属于放热反应 | D. | 一定属于可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第2周期元素氢化物的稳定性顺序是HF>H2O>NH3,则第3周期元素氢化物的稳定性顺 序也是:HCl>H2S>PH3 | |
| B. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4,则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | NCl3中N原子是sp3杂化,则BCl3中B原子也是sp3杂化 | |
| D. | 干冰CO2是分子晶体,则SiO2也是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键是一种作用力 | |
| B. | 化学键可以使原子相结合,也可以使离子相结合 | |
| C. | 化学反应过程中,反应物分子内的化学键断裂,产物分子内的化学键形成 | |
| D. | 极性键不是一种化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大气雾霾污染现象的产生与汽车尾气排放有关 | |
| B. | 玻璃和氮化硅陶瓷都属于新型无机非金属材料 | |
| C. | 活性炭与二氧化硫都可用于漂白,其漂白原理相同 | |
| D. | 空气中的臭氧对人体健康有益无害 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1 367.0 kJ•mol-1(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-296.8 kJ•mol-1(反应热) | |
| D. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=+110.5 kJ•mol-1(燃烧热) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com