
 水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图所示,下列关于水的说法正确的是( )
水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图所示,下列关于水的说法正确的是( )| A. | 水是弱电解质,某温度下,纯水的pH=6,则说明显酸性 | |
| B. | 可燃冰是可以燃烧的水 | |
| C. | 在相同温度下,水的电离常数与水的离子积常数相等 | |
| D. | 在水中加入Na或NaH,都将促进水的电离 |
分析 A.任何温度下,纯水溶液都呈中性,水部分电离,所以为弱电解质;
B.可燃冰的主要成分是甲烷;
C.Kw=c(H+).c(OH-),水的电离平衡常数=$\frac{c({H}^{+}).c(O{H}^{-})}{c({H}_{2}O)}$;
D.Na、NaH都和水电离出的氢离子反应生成氢气.
解答 解:A.任何温度下,纯水溶液都呈中性,水部分电离,所以为弱电解质,所以某温度下,纯水的pH=6,该温度下水仍然呈中性,故A错误;
B.可燃冰的主要成分是甲烷而不是水,故B错误;
C.Kw=c(H+).c(OH-),水的电离平衡常数=$\frac{c({H}^{+}).c(O{H}^{-})}{c({H}_{2}O)}$,所以其电离平衡常数不等于离子积常数,故C错误;
D.Na、NaH都和水电离出的氢离子反应生成氢气,所以在水中加入Na或NaH,都将促进水的电离,故D正确;
故选D.
点评 本题考查水的电离及溶液酸碱性判断,为高频考点,侧重考查学生分析判断能力,明确水的性质及水电离特点是解本题关键,注意:任何温度下纯水都呈中性,但pH不一定是7,易错选项是A.


科目:高中化学 来源: 题型:解答题
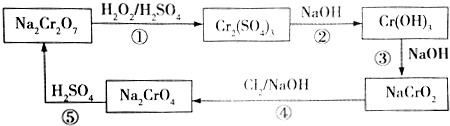
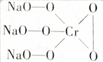 ,则Cr的化合价为+5,其中含有的化学键有离子键、共价键.
,则Cr的化合价为+5,其中含有的化学键有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
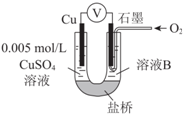 某小组同学利用原电池装置探究物质的性质.
某小组同学利用原电池装置探究物质的性质.| 装置 | 编号 | 电极A | 溶液B | 操作及现象 |
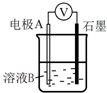 | Ⅰ | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
| 编号 | 溶液B | 操作及现象 |
| Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
| Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
| Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量CH3COONa固体 | B. | 通入少量氯化氢气体 | ||
| C. | 提高温度 | D. | 加入少量水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO3)=0.15mol•L-1 | B. | c(SO3)=c(SO2)=0.075 mol•L-1 | ||
| C. | c(SO3)=0.2 mol•L-1 | D. | c(O2)=0.05 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
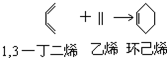
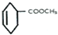
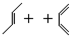 →
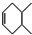
→
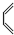 +
+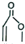 →
→
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
某同学体检的血液化验单中,出现了如下图所示的体检指标。表示该体检指标的物理量是
甘油三酯 | 0.52 | mmol/L |
总胆固醇 | 4.27 | mmol/L |
高密度脂蛋白胆固醇 | 1.57 | mmol/L |
低密度脂蛋白胆固醇 | 1.40 | mmol/L |
葡萄糖 | 4.95 | mmol/L |
A.溶解度 B.物质的量浓度 C.质量分数 D.摩尔质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com