
| 1 |
| 4 |

| 1 |
| 4 |
| 1 |
| 4 |
| c2(CO)c2(H2) |
| c(CH4)c(CO2) |
(
| ||||
|


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:

| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D四种短周期元素,A、B为同周期元素,B、C同主族,B、C可形成共价化合物BC3和BC2,A、D同主族,A的原子结构示意图如图1,据此填空:
A、B、C、D四种短周期元素,A、B为同周期元素,B、C同主族,B、C可形成共价化合物BC3和BC2,A、D同主族,A的原子结构示意图如图1,据此填空:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
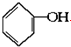 合成
合成 :
:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 化学式 | 键长/nm | 键角 | 沸点/℃ |
| H2S | 1.34 | 92.3° | -60.75 |
| H2Se | 1.47 | 91.0° | -41.50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com