
【题目】【江西省师大附中、临川一中2017届高三1月联考理综】等体积浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②HSCN溶液、③NaHCO3溶液混合,①、②分别与③混合,实验测得产生的CO2气体体积(V)随时间(t)的变化如图所示,下列说法正确的是( )
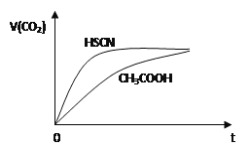
A. 三种溶液pH的比较③>②>①
B. 反应结束后所得两溶液中,c(CH3COO-)>c(SCN-)
C. 上述三种溶液中水电离的电离度:NaHCO3>CH3COOH>HSCN
D. ①与③反应所得的溶液中:c(CH3COO-) + c(CH3COOH) = 0.1mol/L
【答案】C
【解析】
NaHCO3溶液呈碱性,PH〉7,HSCN与NaHCO3反应先完成,速率快,说明HSCN中H+浓度大于CH3COOH中H+浓度,酸性大,则PH小,三种溶液pH的③>①>②,A错误。HSCN酸性大于CH3COOH,SCN-水解程度小于CH3COO-,则溶液中c(SCN-)>c(CH3COO-),B错误。NaHCO3可水解,促进水的电离,CH3COOH、HSCN为酸,均抑制水的电离,HSCN酸性大于CH3COOH,HSCN抑制能力大 ,水的电离程度小,水电离的程度:NaHCO3>CH3COOH>HSCN,C正确。等体积浓度CH3COOH溶液与NaHCO3溶液混合,体积变为2倍,根据物料守恒有:c(CH3COO-) + c(CH3COOH) = 0.05mol/L,D错误。


科目:高中化学 来源: 题型:
【题目】【陕西省榆林市2017届高考模拟第一次测试理综】常温下,各取1mL PH=2的两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是
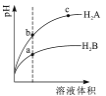
A. H2A的酸性比H2B弱
B. c点溶液的导电性比a,b点溶液的导电性都强
C. 若0.1mol/LNaHA溶液的PH=4,离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A) >c(H+)>c(OH-)
D. Na2B的水溶液中,离子浓度大小为试卷c(Na+)>c(B2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究。
回答下列问题:
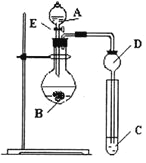
(1)图中D装置名称是 。
(2)从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液②稀盐酸③碳酸钙④Na2SiO3溶液⑤SiO2
试剂A为_________;试剂C为_________(填序号)。
(3)乙同学设计的实验所用到试剂A为________;试剂C为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷的叙述正确的是( )
A. 液化石油气的主要成分 B. 含碳质量分数最大的有机物
C. 最简单的有机物 D. 1mol甲烷含有8mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
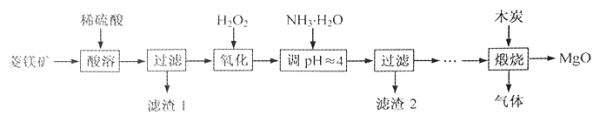
(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C ![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分布吸收或收集。
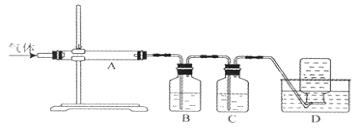
①D中收集的气体是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a.NaOH溶液 B.Na2CO3溶液 C.稀硝酸 D.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中短周期的一部分,其中Y元素的原子序数为M与N元素原子序数之和。下列说法正确的是
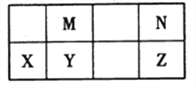
A. 氢化物的稳定性:N >Z,是因为其氢化物分子可形成氢键
B. 元素的非金属性:M > Y,是因为单质M能与YN2反应生成单质Y
C. 熔沸点:YN2>MN2,是因为YN2的分子间作用力强
D. 简单离子的半径:N >X,是因为它们具有相同的电子层结构且X的核电荷数更大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:

已知:CaO2·8H2O呈白色微溶于水。
(1)写出反应①中氧化还原反应的离子方程式: ______________。
(2)向反应①后的溶液中加浓氨水的目的是: __________________。
(3)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①__________________;②______________。
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴滴入浓度为c mol·L-1的Na2S2O3标准溶液至反应终点,消耗Na2S2O3溶液V mL。
已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() 。
。
①滴定终点的现象为____________,产品中CaO2的质量分数为_________________
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________ (填“不受影响”“偏低”或“偏高”),原因是_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二氧化硫可使酸性高锰酸钾溶液褪色,化学反应方程式为:
5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4
用下图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2。试用如图所列各装置设计一个实验,来验证上述反应所产生的各种产物。
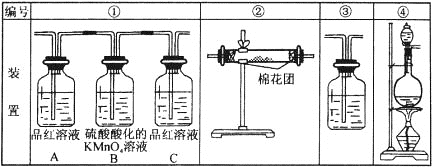
(1)这些装置的连接顺序是(按产物气流从左至右的方向,填写装置的编号):______→____→____→____。
(2)实验时可观察到装置①中A瓶的溶液褪色。A瓶溶液的作用是_________,B瓶溶液的作用是_______, C瓶溶液的作用是________________。
(3)装置②中所加的固体药品是____________,可验证的产物是____________。
(4)装置③中所盛溶液是_____________,可验证的产物是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com