
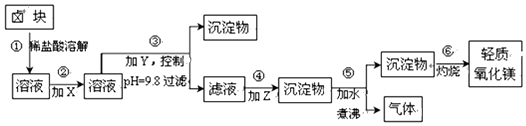
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6 | b.双氧水(含30%H2O2) | 1500 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2200 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO) | 800 |
分析 为除去Fe2+,先将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO,
(1)依据图表数据和经济效益分析加入的试剂的最佳选择;
(2)次氯酸钠具有氧化性在酸溶液中氧化亚铁离子为铁离子,据此写出反应的离子方程式;Z为碳酸钠,则步骤④生成沉淀为碳酸镁,碳酸镁在加热条件下水解生成氢氧化镁和二氧化碳气体;
(3)步骤③的目的在于使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去;
(4)灼烧需要的仪器有铁三脚、酒精喷灯、坩埚、泥三角;
(5)根据c(OH-)=$\sqrt{\frac{Ksp(氢氧化镁)}{c(M{g}^{2+})}}$计算;
(6)①KMnO4溶液的紫红色可指示反应终点;
②根据5Fe2+~KMnO4,计算铁元素的质量,再计算铁元素的质量分数;
(7)①在配制标准溶液过程中,烧杯中的KMnO4溶液有少量溅出,配制的标准液浓度偏低,消耗标准液体积偏大,测定结果偏高;
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使标准液消耗体积读书偏小,使测定结果偏低.
解答 解:(1)步骤②是为了将Fe2+氧化成Fe3+,并在控制合适的pH条件时生成Fe(OH)3沉淀而除之,虽然漂液和H2O2都可采用,但对比表2提供的原料价格可以看出,漂液比H2O2的价格低得多,所以选漂液最合理,故X为漂液;加入Y的目的是调节pH,选用氢氧化钠,故Y为烧碱;加入Z的目的是使镁离子沉淀,Z为纯碱;
故答案为:a、c、d;
(2)流程中加入次氯酸钠在酸性溶液中会氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
加入的Z物质为纯碱,所以步骤④生成的沉淀物是MgCO3,所以沉淀物MgCO3在煮沸的情况下发生水解,生成Mg(OH)2和CO2气体,反应的化学方程式为:MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑,
故答案为:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑;
(3)步骤③的目的在于使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去,应加入NaOH,如加入纯碱,不能达到较高的PH,分析表1提供的数据:除去杂质离子合理的pH范围是3.7<pH<9.8,在此范围内,如果pH过高,就会有大量的Mg2+生成Mg(OH)2而进入沉淀中,从而导致生产成本的提高;为了兼顾产品质量和生产成本,选择pH=9.8最合理,当然此时Mg2+也会部分生成Mg(OH)2沉淀,但由于卤块价格低廉,这点不可避免的损失还是可以承受的,以此保证产品的纯度;
故答案为:9.8;使Mg2+以外的杂质尽可能彻底地转化为沉淀除去;
(4)灼烧需要的仪器有铁三脚、酒精喷灯、坩埚、泥三角;
故答案为:ABCE;
(5)已知在25℃时,Ksp[Mg(OH)2)=3.2×10-11,向0.02mol•L-1的MgCL2溶液中加入NaOH固体,如要生成Mg( OH )2沉淀,应使溶液中的c( OH-)最小为$\sqrt{\frac{3.2×1{0}^{-11}}{0.02}}$=4×10-5mol/L;
故答案为:4×10-5;
(6)①本实验中,用KMnO4滴定,KMnO4溶液的紫红色可指示反应终点,所以不需加入指示剂;
故答案为:否;KMnO4溶液的紫红色可指示反应终点;
②根据5Fe2+~KMnO4,则样品中铁元素的质量为:$0.01mol/L×20×1{0}^{-3}L×\frac{100mL}{25mL}×56g/mol$=0.224g,则残留物中铁元素的质量分数是$\frac{0.224g}{5g}×100%$=4.480%;
故答案为:4.480%;
(7)①在配制标准溶液过程中,烧杯中的KMnO4溶液有少量溅出,配制的标准液浓度偏低,消耗标准液体积偏大,测定结果偏高;
故答案为:偏高;
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使标准液消耗体积读书偏小,使测定结果偏低;
故答案为:偏低.
点评 本题考查了物质的制备,涉及物质制备实验方案的设计、滴定实验误差分析、物质的配制等知识点,题目难度中等,注意掌握化学基本实验操作方法,明确物质制备实验方案设计原则,本题中合理分析制取流程、得出氧化镁的制备原理为解题的关键,试题综合性较强、涉及知识点较多,充分考查了学生的分析、理解能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
 铜与浓硝酸反应和铜与稀硝酸反应的产物不同,实验现象也不同.
铜与浓硝酸反应和铜与稀硝酸反应的产物不同,实验现象也不同.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 | |
| B. | 为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中 | |
| C. | 为减少“白色污染”,应严格执行“禁塑令” | |
| D. | 为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g CH4O中含有的C-H键数目为NA | |
| B. | 25℃时,100mL pH=8的氨水中NH4+的个数为9.9×10-8NA | |
| C. | 56g Fe和64g Cu分别与1 mol S反应转移的电子数均为2NA | |
| D. | 标准状况下,2.24 LCl2溶于水所得氯水中含氯的微粒总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熟石灰 | B. | 草木灰 | C. | 明矾 | D. | 漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可用作食品干燥剂和催化剂的载体 | |
| B. | 铝盐、铁盐净水原理与氯气净水原理相同 | |
| C. | 浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 | |
| D. | 电解熔融NaC1或A1C13制取Na或A1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3常用作红色油漆和涂料 | B. | 生物柴油与柴油的化学成分相同 | ||
| C. | 聚丙烯酸钠可做“尿不湿”原料 | D. | 液氯或浓硫酸可用钢瓶储存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为12的碳原子符号:${\;}_{12}^{12}$C | |
| B. | 氧原子的结构示意图: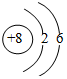 | |
| C. | CO2分子的电子式: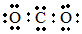 | |
| D. | 乙炔的结构简式:CH2=CH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com