
分析 酸是指电离时生成的阳离子全部是氢离子的化合物;碱是指电离时生成的阴离子全部是氢氧根离子的化合物;盐是指由金属离子和酸根离子组成的化合物;氧化物是由两种元素组成并且一种元素是氧元素的化合物,据此解答.
解答 解:①CH3COOH电离时生成的阳离子全部是氢离子,属于酸;
②CH3CH2OH是非电解质,不能电离,既不是酸、碱又不是盐,含有CHO三种元素,也不氧化物;
③NaHSO4 由金属离子和酸根离子组成的化合物,属于盐;
④H3PO4 电离时生成的阳离子全部是氢离子,属于酸;
⑤Cu(OH)2CO3 由金属离子和酸根离子、氢氧根离子组成的化合物,属于碱式盐;
⑥CH4是有机物,不能电离,不是酸、碱、盐、氧化物;
⑦Ca(OH)2 电离时生成的阴离子全部是氢氧根离子的化合物,属于碱;
⑧SO3 两种元素组成并且一种元素是氧元素的化合物,属于氧化物;
⑨Na2O2 两种元素组成并且一种元素是氧元素的化合物,属于氧化物;
⑩Na2CO3由金属离子和酸根离子组成的化合物属于盐;
所以:属于酸的是:①④;属于碱的是:⑦;属于盐的是:③⑤⑩;氧化物的是:⑧⑨;
故答案为:①④;⑦;③⑤⑩;⑧⑨.
点评 本题考查了物质的分类,熟悉酸碱盐氧化物的概念即可解答,注意盐又可分为酸式盐、碱式盐和正盐,题目简单.


科目:高中化学 来源: 题型:选择题
| A. | 此时16O的相对原子质量为32 | |
| B. | 40gNaOH溶于水配成1L溶液,其物质的量浓度为1 mol/L | |
| C. | 标况下44gCO2的体积为22.4L | |
| D. | NA个氧分子与NA个氢分子有相同数目的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
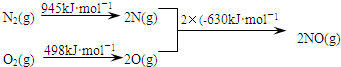
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电离程度:①<② | |
| B. | ①、②中粒子浓度关系均符合:c(Na+)+c(H+)=c(OH+)+c(HCO2-)+c(CO32-) | |
| C. | 将③、④混合,所得溶液的pH>7,则该溶液中:c(NH4+)+c(NH3.H2O)<0.1mol.L-1 | |
| D. | 向③、④中分别加入25mL0.1mol.L-1盐酸后,溶液中c(NH4+):③<④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,平衡向正反应方向移动,溶液中n(H+)增大 | |
| B. | 加入少量冰醋酸,平衡向正反应方向移动,溶液中c(H+)增大 | |
| C. | 加入少量0.1 mol•L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向逆反应方向移动,溶液中c(H+)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物 氧化铁 FeO | B. | 酸性氧化物 碳酸气 CO2 | ||
| C. | 酸 硫酸 H2S | D. | 盐 纯碱 NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com