
下列说法正确的是( )
A.碘化铵和氯化铵受热分解过程中破坏和形成的化学键类型完全相同
B.反应N2H4(I)=N2(g)+2H2(g)是一个△S>0的反应
C.40g金刚砂(SiC)中含有C—Si键的个数为2NA(NA为阿伏加德罗常数)
D.HClO是弱酸,所以NaClO是弱电解质
B
解析试题分析:碘化铵受热分解分两步,第一步得到NH3和HI,接着HI又分解产生H2和I2,所以和氯化铵的分解过程截然不同,所以A错;N2H4(l)=N2(g)+2H2(g)反应中液态物质变成了2中气体,所以是个熵增加的过程△S>0,B正确;40g金刚砂为1mol,则Si、C原子各1mol,在SiC分子中每个Si原子形成四个共价键与C原子相连,而每个C原子也是形成四个共价键与Si原子相连,所以共价键各占一半,所以共价键数目为2NA +2NA =4NA ,C错误;NaClO属于盐类,是强电解质,D错误;故选B。
考点:本题考查的是铵盐的分解、熵变的判断、晶体中共价键数目计算、强弱电解质等知识。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:单选题
在酸性溶液中,下列各组离子能大量共存且溶液为无色透明的是
| A.Na+、K+、OH—、Cl— |
| B.Na+、Fe2+、SO42—、NO3— |
| C.Mg2+、Na+、SO42—、 Clˉ |
| D.K+、Na+、NO3—、CO32— |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等。为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是
| A.溶液中无法确定Al3+的存在与否 |
| B.原溶液中不含的离子为:K+、Al3+、CO32- |
| C.步骤②中可以确定Fe2+、NO3-的存在 |
| D.步骤③中共有2种钡盐沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某溶液,只可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、NO2-、CO32-、NO3-,现取两份200mL溶液进行如下实验:(已知HNO2不稳定极易分解2HNO2=H2O+NO2↑+NO↑)①第一份加足量AgNO3溶液后,有11.68g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.2g;②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀2.0g,该沉淀能溶于稀盐酸产生无色气体;③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用100mL0.5mol·L-1的稀硫酸恰好完全吸收,酸也不剩余。
根据上述实验,以下推测不正确的是( )
| A.原溶液一定不存在较大浓度的H+、Mg2+ |
| B.原溶液确定含NH4+、NO2-、CO32-,且物质的量之比为5︰2︰1 |
| C.不能确定原溶液是否含有K+、NO3- |
| D.实验中产生的棕色气体遇空气颜色会加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在pH=13的无色溶液中,下列各组离子能大量共存的是
A.K+、Na+、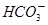 、 、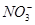 | B.Na+、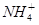 、 、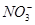 、Cl- 、Cl- |
C.K+、Na+、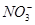 、Br- 、Br- | D.K+、Cu2+、Cl-、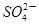 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列三种化合物由左到右是按强电解质、弱电解质、非电解质的顺序排列的一组是
| A.HCl、CaCO3、SO2 | B.KNO3、CH3COOH、NH3 |
| C.HClO、H2S、C2H5OH | D.BaSO4、H3PO4、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式正确的是( )
| A.铁溶于足量的稀硝酸,溶液变黄:3Fe+8H++2NO3-= 3Fe2++2NO↑+4H2O |
| B.NaHSO4溶液与NaOH溶液混合:OH-+H+= H2O |
C.NH4HCO3溶液与足量KOH浓溶液共热:NH4++OH-  NH3↑+H2O NH3↑+H2O |
| D.Fe2O3溶于足量的氢碘酸溶液中:Fe2O3+6H+=2Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应的离子方程式书写正确的是( )
| A.氯化铝溶液中加入过量氨水:Al3++4NH3?H2O =AlO2-+4NH4++2H2O |
| B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3- =CaCO3↓+ H2O |
| C.碳酸钙溶于醋酸CaCO3+2H+=Ca2++CO2↑+H2O |
| D.氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的有几项
①氯化钠溶液能导电,所以氯化钠溶液是电解质
②BaSO4投入水中,导电性较弱,故它是弱电解质
③氯化氢水溶液能导电,所以氯化氢是电解质
④三氧化硫溶于水能导电,所以三氧化硫是电解质
⑤铜能导电,所以是电解质
⑥CaCO3投入水溶液几乎不能导电,但CaCO3是强电解质
⑦氯气溶于水能导电所以氯气为电解质
| A.1 | B.2 | C.3 | D.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com