
| A. | 该溶液中,K+、Fe2+、I-、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-═Fe2++I2 | |
| C. | 1L0.1mol/L该溶液和足量的Cu充分反应,离子方程式为Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |
分析 A.离子之间发生氧化还原反应;
B.电子、电荷不守恒;
C.Cu与铁离子发生氧化还原反应;
D.不符合离子的配比.
解答 解:A.Fe3+、I-发生氧化还原反应,不能大量共存,故A错误;
B.和KI溶液反应的离子方程式为2Fe3++2I-═2Fe2++I2,故B错误;
C.Cu与铁离子发生氧化还原反应,离子反应为Cu+2Fe3+═Cu2++2Fe2+,故C正确;
D.和Ba(OH)2溶液反应的离子方程式为2Fe3++3SO42-+3Ba2++6OH-═2Fe(OH)3↓+3BaSO4↓,故D错误;
故选C.
点评 本题考查离子的共存及离子反应,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g/mol) |
| 蔗糖(C12H22O11) | 25.00 | 342 |
| 硫酸钾 | 0.25 | 174 |
| 阿司匹林(C9H8O4) | 0.17 | 180 |
| 高锰酸钾 | 0.25 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
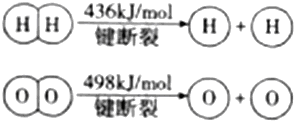
| A. | 该反应原理可用于设计氢氧燃料电池 | |
| B. | 破坏1mol H-O键需要的能量是926.8kJ | |
| C. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.8kJ/mol | |
| D. | H2(g)中的H-H键比H2O(g)中的H-O键能小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H$\underset{\stackrel{\;}{C}}{•}$$\underset{\stackrel{\;}{l}}{•}$ | B. | $\underset{\stackrel{\;}{F}}{•}$$\underset{\stackrel{\;}{e}}{•}$Cl2 | C. | K$\underset{\stackrel{\;}{M}}{•}$$\underset{\stackrel{\;}{n}}{•}$O4 | D. | Na2$\underset{\stackrel{\;}{S}}{•}$O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有很强的生物活性 | B. | 是一种十分稳定的化合物 | ||
| C. | 能增强人体抗病能力 | D. | 具有除尘、除臭和杀菌等作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨的pH<5.6 | |
| B. | SO2、NO2都能引起酸雨 | |
| C. | 雾霾一定是由汽车尾气引起的 | |
| D. | 空气中的SO2主要来自煤、石油的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成 H2 的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
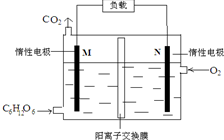 一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能,下列说法中不正确的是( )
一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能,下列说法中不正确的是( )| A. | 与等量的C6H12O6完全燃烧放热比较,该装置发电效率高 | |
| B. | 若用该电池电解氧化铝制铝,与N极相连的电极有气体生成 | |
| C. | 电子流向:M→负载→N→电解质溶液→M | |
| D. | 当N极消耗5.6L(标况下)气体时,最多有NA个H+通过阳离子交换膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com