
| A. | 常温常压下,56g由N2和CO组成的混合气体含有的原子数目为4 NA | |
| B. | 高温下,0.2 molFe与足量水蒸气反应,生成的H2分子数为0.3NA | |
| C. | 1 L 1.0mol•L-1的NaAlO2水溶液中含有的总原子数为2NA | |
| D. | 1 mol羟基中含有的电子数为10NA |
分析 A.氮气和一氧化碳的摩尔质量都是28g/mol,根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算;
B.红热的铁与水蒸气可发生反应:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,结合定量关系计算;
C.偏铝酸钠水溶液中含有偏铝酸钠和水;
D.羟基为中性原子团,1mol羟基含有9mol电子.
解答 解:A.56g氮气和一氧化碳的物质的量为2mol,2mol混合气体中含有4mol原子,含有的原子数目为4NA,故A正确;
B.红热的铁与水蒸气可发生反应:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,0.3molFe粉与足量水蒸气反应,生成0.4molH2,生成的H2分子数为0.4NA,故B错误;
C.1 L 1.0mol•L-1的NaAlO2水溶液中含有溶质偏铝酸钠的物质的量为1mol,1mol偏铝酸钠含有4mol原子,另外溶液中水也含有H、O原子,无法计算溶液中含有原子的物质的量及数目,故C错误;
D.1mol羟基中含有9mol电子,含有的电子数为9NA,故D错误;
故选A.
点评 本题考查阿伏伽德罗常数的综合应用,题目难度不大,明确物质的量与其它物理量之间的关系为解答关键,C为易错点,注意水分子中也含有原子,试题培养了学生的分析能力及化学计算能力.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | AlCl3 溶液与烧碱溶液反应,当 n(OH-):n(Al3+)=7:2 时,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | CuCl2 溶液与 NaHS 溶液反应,当 n(CuCl2):n(NaHS)=1:2 时 Cu2++2HS-═CuS↓+H2S↑ | |
| C. | Cl2 与 FeBr2 溶液反应,当 n(Cl2):n(FeBr2)=1:1 时,2Fe2++4Br-+3Cl2═2 Fe3++2Br2+6Cl- | |
| D. | Fe 与稀硝酸反应,当 n(Fe):n(HNO3)=1:2 时,3 Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
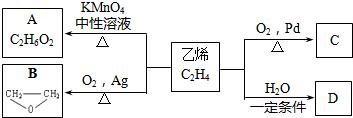
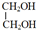 +2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
+2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ④ | |||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
 .②形成的最高价氧化物的结构式O=C=C.
.②形成的最高价氧化物的结构式O=C=C.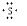 +
+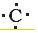 +
+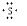 →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的原子结构示意图: | |
| B. | 氯化铵的电子式: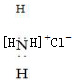 [H [H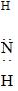 H]+Cl- H]+Cl- | |
| C. | 原子核内有10个中子的氧原子:188O | |
| D. | 用电子式表示水的形成过程:H×+ +×H→ +×H→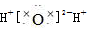 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
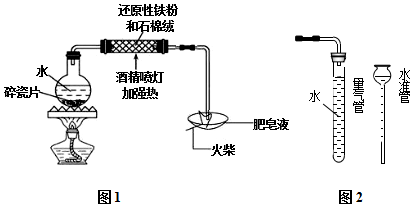
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mo1H2O分子所含中子数为8NA | |
| B. | 30g乙烷中所含的共价键数为6 NA | |
| C. | 常温下,1LpH=1的H2SO4溶液中,含有H+的数目为0.2 NA | |
| D. | 100 mL0.1mol•L-1的CuCl2溶液中,含有Cu2+的数目为0.01 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com