
| A、H2的摩尔质量是2g |
| B、标准状态下,1molH2O 的体积是22.4L |
| C、氧气的摩尔质量是32g/mol |
| D、2gH2含6.02×1023 个H |
| m |
| M |
| N |
| NA |
| m |
| M |
| 2g |
| 2g/mol |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
| A、KNO3 |
| B、NH4NO3 |
| C、NH4H2PO4 |
| D、K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
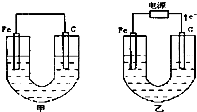 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉溶液具有丁达尔效应 |
| B、光线通过胶体可以产生丁达尔效应的原因是光的散射 |
| C、胶体的分散质粒子可以通过滤纸孔隙,所以可以通过过滤操作分离溶液和胶体 |
| D、胶体属于介稳体系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| B、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
| C、向明矾溶液中加入过量氢氧化钡溶液:Al3++2SO2-4+2Ba2++4OH-=2BaSO4↓+AlO-2+2H2O |
| D、等物质的量的NaHCO3和Ca(OH)2溶液混合:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铜和稀盐酸反应 |
| B、氢氧化钡溶液滴入稀硫酸中 |
| C、氢氧化钠溶液与硝酸反应 |
| D、醋酸和氢氧化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
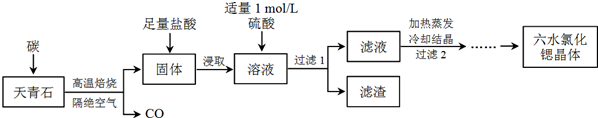
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com