
如图所示是Zn和Cu(稀硫酸)形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是 ( )
| ① Cu为负极,Zn为正极 ② H+向负极移动 ③ 电子的流动方向是:Zn→Cu ④ Cu极上有H2产生 ⑤ 若有1mol电子流经导线,则可产生0.5mol H2气体 ⑥ 正极反应式:Zn-2e-===Zn2+ |
A.①②③ B.③④⑤
C.④⑤⑥ D.②③④
科目:高中化学 来源: 题型:
现将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则过剩的锌粉的质量为( )
A.1.0g B.2.0g C.2.5g D.3.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
现用18.4 mol·L-1的浓硫酸配制450mL 0.2 mol·L-1的稀硫酸,可供选择的仪器有:
①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤托盘天平
(1)上述仪器在配制过程中不需要用到的是__________________。(填序号)除上述仪器外,尚缺最重要的仪器是 。
(2)计算所需浓硫酸的体积为___________mL(保留1位小数)。
(3)实验中用到玻璃棒,其作用分别是:___________、__________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序
为:②→①→③→____ →____→____→____→④(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏高的有____________(填序号)
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.定容时,俯视容量瓶刻度线进行定容
C.将稀释后的硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
查看答案和解析>>
科目:高中化学 来源: 题型:
 反应:A(气)+3B(气) 2C(气) △H<0达平衡后,将气体混和物的温度降低,下列叙述中正确的是 ( )
反应:A(气)+3B(气) 2C(气) △H<0达平衡后,将气体混和物的温度降低,下列叙述中正确的是 ( )
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
 B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动 .
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动 .
C.正反应速率和逆反应速率都变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,水的电离可达到平衡:H2O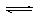 H++OH- △H>0,下列叙述正确的( )
H++OH- △H>0,下列叙述正确的( )
A. 向水中加入NaOH固体,平衡逆向移动,c(OH-)降低
B. 将水加热,Kw增大,c(OH-)不变
C. 向水中加入少量CH3COONa固体,平衡逆向移动。
D. 向水中加入少量稀硫酸,c(H+)增大,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,将这二种物质混合时可发生如下反应:N2H4+2 H2O2 N2+4H2O,已知0.4 mol液态肼和足量的液态双氧水反应,生成氮气和水蒸汽,放出256.6kJ的热量。
N2+4H2O,已知0.4 mol液态肼和足量的液态双氧水反应,生成氮气和水蒸汽,放出256.6kJ的热量。
(1)反应的热化学方程式为_________________________________________________。
(2)又已知:H2O(l) H2O(g);ΔH=+44 kJ/mol。则16 g液态肼和足量的液态双氧水反应生成液态水时放出的热量是_______________kJ。
H2O(g);ΔH=+44 kJ/mol。则16 g液态肼和足量的液态双氧水反应生成液态水时放出的热量是_______________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有很大的优点是
(4) 事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计
成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2[NaAl(OH )4]+CO2→2Al(OH)3↓+Na2CO3+H2O。向含2molNaOH、1molBa(OH)2、2mol[NaAl(OH)4]的混合液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是
)4]+CO2→2Al(OH)3↓+Na2CO3+H2O。向含2molNaOH、1molBa(OH)2、2mol[NaAl(OH)4]的混合液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语正确的是:( )
A.Cl-的结构示意图: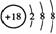
B.光导纤维主要成分的化学式:Si
C.1H2、2H2、3H2互为同位素
D.质子数为53,中子数为78的碘原子:131 53I
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com