
| A、在盐酸溶液中,AgCl的溶解度会减小 |
| B、向存在AgCl沉淀的少量溶液中加入NaI固体,会生成黄色沉淀 |
| C、向AgNO3溶液中加入足量盐酸,反应后的溶液中没有Ag+ |
| D、达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
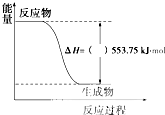 (1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
(1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、产生的淡黄色沉淀为AgI |
| B、产生的黄色沉淀为AgBr |
| C、由上述实验现象可说明溶解度S(AgBr)>S(AgI)>S(AgCl) |
| D、上述实验理解说明沉淀可相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+300 kJ?mol_1 |
| B、+150 kJ?mol_1 |
| C、-300 kJ?mol_1 |
| D、-150 kJ?mol_1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 800℃时,在2L密闭容器中发生2NO(g)+O2(g)?2NO2(g),测得n(NO)随时间的变化如下表:
800℃时,在2L密闭容器中发生2NO(g)+O2(g)?2NO2(g),测得n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠保存在煤油中 |
| B、存放FeSO4溶液时加入少量铁粉 |
| C、NaOH溶液保存在带橡胶塞的玻璃试剂瓶中 |
| D、FeCl3溶液保存在广口瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com