
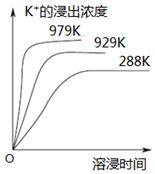
 已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4 (s)?2Ca2++2K++Mg2++4SO42-.不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )
已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4 (s)?2Ca2++2K++Mg2++4SO42-.不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )| A. | 该平衡的Ksp=c2(Ca2+)•c2(K+)•c(Mg2+)•c4(SO42-) | |
| B. | 向该体系中加入饱和K2SO4溶液,溶解平衡向左移动 | |
| C. | 升高温度,溶浸速率增大,平衡向正反应方向移动 | |
| D. | 向该体系中加入饱和NaOH溶液,溶解平衡不发生移动 |
分析 A.K为生成物浓度幂之积与反应物浓度幂之积的比;
B.加入饱和K2SO4溶液,SO42-浓度增大;
C.溶解平衡为吸热反应;
D.加入饱和NaOH溶液,Ca2+和Mg2+浓度减小.
解答 解:A.由反应可知,该平衡的Ksp=c2(Ca2+)•c2(K+)•c(Mg2+)•c4(SO42-),故A正确;
B.加入饱和K2SO4溶液,SO42-浓度增大,则溶解平衡向左移动,故B正确;
C.由图可知,溶解平衡为吸热反应,则升高温度,溶浸速率增大,平衡向正反应方向移动,故C正确;
D.加入饱和NaOH溶液,Ca2+和Mg2+浓度减小,则溶解平衡正向移动,故D错误;
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp及温度、浓度对溶解平衡的影响为解答的关键,侧重分析与应用能力的考查,注意选项C结合图象分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,含有6.02×1024个电子的重水(D2O)的质量约为18g | |
| B. | 常温下,0.5molAl与足量的盐酸反应,转移的电子数约为9.03×1022 | |
| C. | 标况下,17g NH3和22.4LH2O含有相同的电子数 | |
| D. | 50mL0.5mol/L Na2SO4溶液中所含的Na+数目和0.005mol F_所含电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 微粒 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
 .
.
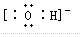 ,F粒子是
,F粒子是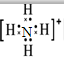 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
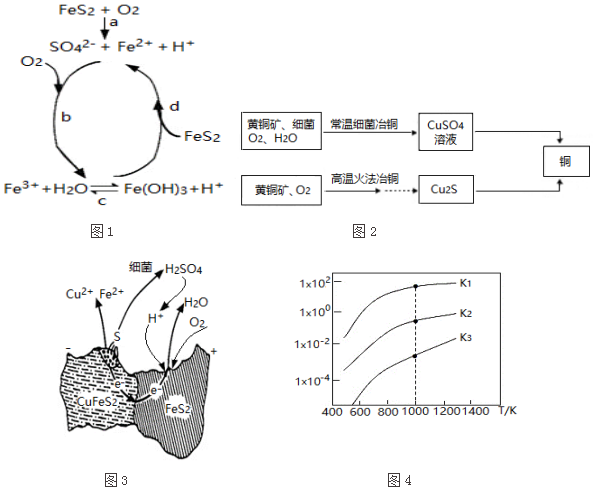
| 相关反应 | 反应热 | 平衡常数 |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物X是烃类物质 | B. | 化合物X的实验式为CH4 | ||
| C. | 化合物X具有多种同分异构体 | D. | 可以确定化合物X的结构式 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A的 氢化物 | B的 氢化物 | C的 氢化物 | X的 氧化物 | Y的氢化物 分子构型 | Z原子 |
| 含氢量最高 的有机物 | 水溶液 呈碱性 | 水溶液 呈酸性 | 两性 氧化物 | 正四面体 | 价电子排布为4s2 |
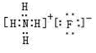 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丁烷的一溴代物有4种 | |
| B. | 乙烯和聚氯乙烯都能使溴水褪色 | |
| C. | 乙醇、乙酸既可用NaOH区分,也可以用小苏打区分 | |
| D. | 乙酸乙酯既能发生加成反应又能发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com