
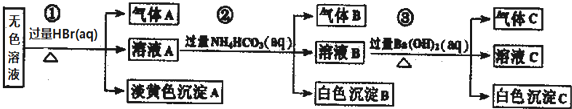
| A. | 根据实验①中的现象可推出,气体A一定是纯净物,淡黄色沉淀一定是AgBr | |
| B. | 根据实验②中的现象可推出,气体B是CO2,沉淀B是Al(OH)3,原溶液中一定含有Al3+ | |
| C. | 根据实验③中的现象可推出,气体C是NH3,沉淀C一定有BaCO3,可能有BaSO4 | |
| D. | 原溶液中肯定含有Na+、AlO2-、S2-,不能确定是否含有SO32-、SO42- |
分析 由①无色溶液加HBr产生淡黄色沉淀,则沉淀A为S或AgBr,由于Ag+与所给的阴离子均不能大量共存,故不可能存在银离子,故沉淀A为S,发生反应为2S2-+SO32-+6H+=3S↓+3H2O,则原溶液中一定存在S2-、SO32-;②溶液A与过量碳酸氢铵反应,则沉淀B为Al(OH)3,气体B为二氧化碳,③溶液B中加过量氢氧化钡反应生成白色沉淀C应为BaCO3(可能含有BaSO4)气体C为氨气,然后结合离子的共存来分析.
解答 解:由①无色溶液加HBr产生淡黄色沉淀,则沉淀A为S或AgBr,由于Ag+与所给的阴离子均不能大量共存,故不可能存在银离子,故沉淀A为S,发生反应为2S2-+SO32-+6H+=3S↓+3H2O,则原溶液中一定存在S2-、SO32-;②溶液A与过量碳酸氢铵反应,则沉淀B为Al(OH)3,气体B为二氧化碳,③溶液B中加过量氢氧化钡反应生成白色沉淀C应为BaCO3(可能含有BaSO4),气体C为氨气;Ag+、Ba2+、Al3+与S2-、SO32-不能共存,则不存在,由电荷守恒可知,一定存在的阳离子为Na+,一定存在的阴离子为S2-、SO32-、AlO2-,
A.根据分析可知,沉淀A为S单质,不是AgBr,故A错误;
B.原溶液中一定含有AlO2-,不存在铝离子,故B错误;
C.根据实验③可知,气体C是NH3,沉淀C一定有BaCO3,可能有BaSO4,故C正确;
D.原溶液中一定存在Na+、S2-、SO32-、AlO2-,故D错误;
故选C.
点评 本题考查常见离子的检验方法,题目难度中等,明确常见离子的性质及检验方法为解答关键,注意利用电荷守恒判断存在离子的方法,试题侧重考查学生的分析能力及逻辑推理能力.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Al3+ | B. | Al3+ | C. | Fe2+、NH4+ | D. | Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫磺有杀虫、杀螨、杀菌作用 | |
| B. | 石膏可以用做雕像材料 | |
| C. | 碳酸钡常用于治疗胃病,俗称“钡餐” | |
| D. | 明矾可做净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
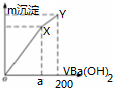
| A. | a=150 | |
| B. | Y点对应溶液为氨水 | |
| C. | OX、XY两段沉淀种类相同 | |
| D. | 继续滴加Ba(OH)2溶液,发生的离子反应为Al(OH)3+OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
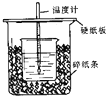 50mL0.50mol/L 盐酸与50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应.
50mL0.50mol/L 盐酸与50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 打开分液漏斗开关,使蒸馏水滴到烧瓶中的电石上 | 制备乙炔气体 |
| B | 乙醇中有少量水,加入生石灰充分搅拌后蒸馏 | 除去乙醇中的水 |
| C | 加入过量饱和溴水 | 检验苯中是否含有苯酚 |
| D | 将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验溴乙烷中的溴原子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com