
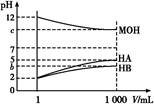
 mol/L=10-9 mol/L,��HB��ҺpH��5,��c(H+)��10-5 mol��L-1,��Һ��ˮ�������
mol/L=10-9 mol/L,��HB��ҺpH��5,��c(H+)��10-5 mol��L-1,��Һ��ˮ������� =c(OH-)��10-9 mol/L,����ˮ�����c(H+)��С˳��ΪMOH=HA��HB��
=c(OH-)��10-9 mol/L,����ˮ�����c(H+)��С˳��ΪMOH=HA��HB��

 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д� �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| �� | ���뷽��ʽ | ����ƽ�ⳣ��K |
| CH3COOH | CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.76��10-5 |
| H2CO3 | H2CO3 H++HCO3�� H++HCO3��HCO3��  H++CO32�� H++CO32�� | K1=4.4��10-7 K2=4.7��10-11 |
| H2S | H2S H++HS- H++HS-HS-  H++S2- H++S2- | K1=1.3��10-7 K2=7.1��10-15 |
| H3PO4 | H3PO4 H++H2PO4�� H++H2PO4��H2PO4��  H++HPO42�� H++HPO42��HPO42��  H++PO43�� H++PO43�� | K1=7.1��10-3 K2=6.3��10-8 K3=4.2��10-13 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��NaHCO3��Һ��ˮϡ�ͣ�c(Na+)/c(HCO3��)�ı�ֵ�������� |
| B��Ũ�Ⱦ�Ϊ0.1 mol��L��1��Na2CO3��NaHCO3�����Һ��2c(Na��)��3[c(CO32��)��c(HCO3��)] |
| C���ڸ��������Һ�У�H+��K+��SO42���������Ƿ��ӿ��Դ������� |
| D����֪��Ksp(AgCl)��1.8��10��10�� Ksp(Ag2Cr2O4)��2.0��10��12����Ag2CrO4���ܽ��С��AgCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
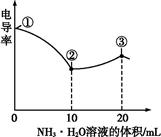
| A���ٵ���Һ��c(H+)Ϊ0.200 mol��L-1 |
| B����Һ�¶ȸߵ�Ϊ��>��>�� |
| C���۵���Һ����c(Cl-)>c(CH3COO-) |
| D���۵����������Ŀ����ʹ��Һ�絼���Խ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CH3COO����H�������ڸ�ƽ������������ȷ���ǣ� ��
CH3COO����H�������ڸ�ƽ������������ȷ���ǣ� ��| A������ˮʱ��ƽ�������ƶ� |
| B����������NaOH���壬ƽ�������ƶ� |
| C����������0.1 mol��L��1���ᣬ��Һ��c(H��)��С |
| D����������CH3COONa���壬ƽ�������ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������Һ��pH=4 |
| B�������¶ȣ���Һ��pH���� |
| C������ĵ���ƽ�ⳣ��ԼΪ1��10-7 |
| D����HA�������c(H+)ԼΪˮ�������c(H+)��106�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Һ��pH��ͬ |
| B���ֱ��������пƬ���������ɵ�H2����� |
| C���ֱ�ϡ��100������Ũ��������Ũ����� |
| D����ˮ�������������Ũ�Ⱦ�Ϊ1��10��12 mol��L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Һ��pHֵ���ڣ��ۣ��� |
| B��ˮ�������c(OH��)���ۣ���=�� |
| C���ٺ͢۵������Ϻ����Һ��c(CH3COOH)+ c(CH3COO��)��0��1mol/L |
| D���ں͢۵������Ϻ����Һ��c(Na+)��c(CH3COOH)+c(CH3COO��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ͨ������HCl���� | B����������NaOH���� | C����������H2O | D�������¶� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com