
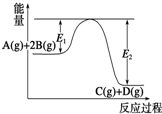
| A. | 该反应为放热反应 | |
| B. | 当反应达到平衡时,降低温度,A的转化率增大 | |
| C. | 压强增大,平衡向正反应方向移动 | |
| D. | 加入催化剂,反应速率增大,E1减小,E2减小,反应热减小 |
分析 A.当反应物的能量高于生成物的能量,反应是放热,反之是吸热;
B.降低温度平衡向放热方向移动;
C.增大压强,平衡向气体体积减小的方向移动;
D.催化剂不会改变反应的焓变.
解答 解:A.由图可知,反应物A(g)和2B(g)的总能量大于生成物C(g)和D(g)的总能量,为放热反应,故A正确;
B.正方向为放热反应,则降低温度平衡向放热方向移动,即正向移动,则A的转化率增大,故B正确;
C.增大压强,平衡向气体体积减小的方向移动,对于该反应而言,平衡正向移动,故C正确;
D.加入催化剂,降低反应的活化能,则E1减小,E2减小,反应速率增大,由于反应物与生成物的总能量差不变,即△H不变,故D错误;
故选D.
点评 本题涉及物质的能量和反应的吸放热之间的关系、催化剂的特点以及温度对化学平衡移动的影响等方面的知识,综合性较强,难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | a电极是该电池的正极 | B. | O2在b电极上发生氧化反应 | ||
| C. | 电解质溶液中OH-向正极移动 | D. | 该装置实现了化学能到电能的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 吸热反应不一定需要加热才能发生 | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)═2CO(g)+O2(g)△H=2×283.0 kJ/mol | |
| C. | HCl和NaOH反应的中加热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44 g C3H8中含有的共价键数为11 NA | |
| B. | 0.1 mol醛基中的电子数为1.5NA | |
| C. | 室温下,28.0 g乙烯和一氧化碳的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4 L乙醇中含有的氧原子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH3COOH+BaCO3→(CH3COO)2Ba+CO2↑+H2O | |
| B. | CH3COOH+KHCO3→CH3COOK+CO2↑+H2O | |
| C. | 2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O | |
| D. | CH3COOH+Na2CO3→CH3COONa+NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
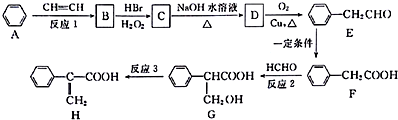
 .
. +HBr→
+HBr→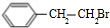 ;②D-E的化学方程式是2
;②D-E的化学方程式是2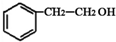 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2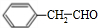 +2H2O;
+2H2O;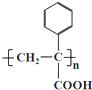
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com