食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K
+、Ca
2+、Mg
2+、Fe
3+、S0
42-等杂质离子,实验室提纯NaCl的流程
如图1:
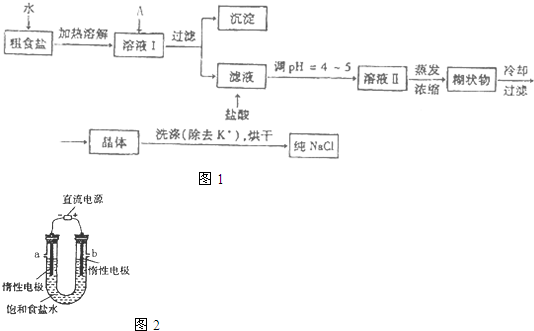
提供的试剂:饱和Na
2C0
3溶液 饱和K
2C0
3溶液 NaOH溶液 BaCl
2溶液 Ba(NO
3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca
2+、Mg
2+、Fe
3+、S0
42-离子,选出A所代表的试剂,按滴加顺序依次为
BaCl2,NaOH,Na2CO3(或NaOH,BaCl2,Na2CO3)
BaCl2,NaOH,Na2CO3(或NaOH,BaCl2,Na2CO3)
(只填化学式).
②洗涤除去NaCl晶体表面附带的少量KCl,所选用的试剂为以上提供试剂中的75%乙醇,请说明原因
用其他试剂会引进杂质离子,75%乙醇可以使固体和溶液充分接触,又不会引进新的杂质离子
用其他试剂会引进杂质离子,75%乙醇可以使固体和溶液充分接触,又不会引进新的杂质离子
o
(2)电解饱和食盐水的装置如图2所示,若收集的H
2为2L.则同样条件下收集的C1
2<
<
(填“>”、“=”或“<”)2L,原因是
电解生成的氯气可以和电解生成的氢氧化钠发生了反应
电解生成的氯气可以和电解生成的氢氧化钠发生了反应
.
装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为
酸碱中和滴定
酸碱中和滴定
.装置a口出来的气体是
H2
H2
.写出该装置中发生的电解反应方程式
.






