
| m |
| M |
| m |
| n |
| m |
| V |
| 2g |
| 2g/mol |
| 16g |
| 32g/mol |
| m |
| n |
| 2g+16g |
| 1.5mol |
| m |
| V |
| 2g+16g |
| 33.6L |
| m |
| M |
| V |
| Vm |
| m |
| V |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纤维素属于髙分子化合物,与淀粉互为同分异构体,水解后均生成葡萄糖 |
| B、2,3一二甲基丁烷的H一NMR上有5个峰 |
| C、含5个碳原子的有机物,每个分子中最多可形成4个C一C单键 |
D、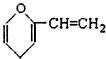 某有机物结构如图所示,该有机物属于芳香族化合物的同分异构体有5种,其中遇FeCl3能显色的有3种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com