
【题目】已知有以下物质相互转化,其中A为常见金属,C为碱。

试回答:
(1)写出F的化学式_______________,H的化学式___________________。
(2)写出由E转变成F的化学方程式:_________________________________。
(3)向G溶液加入A的有关反应离子方程式:____________________。
(4)写出A在一定条件下与水反应的化学方程式并用双线桥标出该反应的电子转移情况__________________。
【答案】Fe(OH)3 AgCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe3++Fe=3Fe2+ 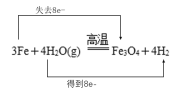
【解析】
白色沉淀E在空气中转变为红褐色沉淀F,可推出E为氢氧化亚铁,F为氢氧化铁,F为氯化铁,故B中含有亚铁离子,透过蓝色钴玻璃观察焰色反应为紫色,可知D中含有K元素,又因为D与硝酸银生成白色沉淀H,可知H为AgCl,D为KCl,所以B中含有氯离子,故B为氯化亚铁,D为KCl和氯化亚铁的混合物,则A为Fe。
(1)由分析可知,F为Fe(OH)3,H为AgCl;
(2)氢氧化亚铁转化为氢氧化铁的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)向G溶液加入A的有关反应离子方程式为2Fe3++Fe=3Fe2+;
(4)Fe与水反应的方程式的电子转移可表示为 。
。


科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
84消毒液
(有效成分)NaClO
(规格)1000ml
(质量分数)37.25%
(密度)1.2g.cm-3
(1)该“84消毒液”的物质的量浓度约为________mol·L-1(保留2位有效数字)。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)_____mol·L-1(保留小数点后2位)。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制230 mL含NaClO质量分数为37.25%的消毒液。
①需要称量NaClO固体的质量为___________g
②其操作步骤可分解为以下几步:
A.将称量准确的NaClO固体,放入烧杯里,加适量蒸馏水使其溶解,并用玻璃棒搅拌
B.用约30mL蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都倒入容量瓶里
C.将NaClO溶液小心地用玻璃棒引流容量瓶里D.检查250mL容量瓶,是否漏水
E.将蒸馏水直接加入容量瓶,至液面接近刻度线
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切
完成上述步骤中的空白处_____________________;正确的操作顺序是(用字母填写):_______________;进行A步骤操作时,必须__________后,才能进行后面的操作。
(4)“84消毒液”与稀硫酸混合使用可增加消毒能力,某消毒小组人员用98%(密度为1.84g/ml)的浓硫酸配制100ml4.6mol/L的稀硫酸,用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为__________mol/L;
②需要量取浓硫酸的体积为__________ml。
(5)将所配制的稀H2SO4进行测定,发现实际浓度小于4.6 mol·L-1。请你分析下列哪些操作会引起所配浓度偏小_______(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.洗涤量筒中的液体注入烧杯
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焰色实验过程中,铂丝的清洗和灼烧与钾焰色实验的观察两项操作如图所示,下列叙述中不正确的是( )

A.每次实验中都要先将铂丝灼烧到火焰颜色,再蘸取被检验物质
B.钾的焰色实验要透过蓝色钴玻璃观察
C.焰色实验是某种金属元素灼烧时所具有的特殊颜色,是化学变化
D.没有铂丝可用无锈铁丝代替进行实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. MgCO3![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
B. NaCl![]() NaHCO3(s)
NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s)
C. SiO2![]() Si
Si![]() SiCl4
SiCl4
D. AgNO3![]() [Ag(NH3)2]OH(aq)
[Ag(NH3)2]OH(aq) ![]() Ag
Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为____________个;
(2)该气体在标准状况下的体积为____________L;
(3)该气体每个分子的质量为_______________g;
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子共存或离子反应的说法正确的是
A.某无色溶液中可能大量存在H+、Cl-、MnO4-
B.pH=2的溶液中可能大量存在Na+、NH4+、CO32-
C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D.稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是
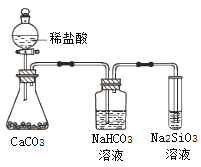
A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如下:

回答下列问题:
①酸雨的pH________(填“>”“<”或“=”)5.6。
②D物质的化学式为____________。
③反应②的化学方程式为___________________________________。
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:____________,反应中氧化剂是___________,还原剂是_______________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为________mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是

A. 原子半径:M>Z>Y>X
B. Z的气态氢化物最稳定,因其分子间存在氢键
C. 最高价氧化物对应水化物的酸性M<Z
D. 元素的非金属性:X<Y<Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com