
室温下,将1.00mol· L-1盐酸滴入20.00mL1.00mol· L-1氨水中,溶液pH随加入盐
酸体积变化曲线如图所示。下列有关说法正确的是
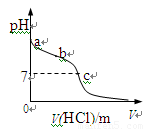
A.a点:pH=14
B.b点:c(NH4+) +c(NH3·H2O) = c(Cl-)
C.c点:水电离出的c(H+) = 1.0×10-7mol· L-1
D.c点后,溶液中离子浓度大小关系一定为:
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C
【解析】
试题分析:氨水是弱碱,1.00mol· L-1氨水中c(OH-)<1.00mol· L-1,pH>14,A错误;当加入盐酸20mL时,盐酸与氨水恰好完全中和,此时溶液呈酸性,所以c点盐酸的体积小于20mL,c点pH=7,水电离的c(H+)=1.0×10-7mol· L-1,C正确;b点为氨水与氯化铵溶液的混合物,c(NH4+) +c(NH3·H2O) > c(Cl-),B错误;c点后,溶液呈酸性,离子浓度关系可能为c(Cl-)>c(NH4+)>c(H+)>c(OH-)
或c(Cl-)>c(H+)>c(NH4+)>c(OH-),D错误。
考点:微粒浓度比较 弱电解质电离平衡 水的电离
点评:盐酸与氯化铵的混合溶液中,离子浓度大小可能为c(Cl-)>c(NH4+)>c(H+)>c(OH-)
或c(Cl-)>c(H+)>c(NH4+)>c(OH-)。


科目:高中化学 来源: 题型:
 室温下,将1.00mol?L-1盐酸滴入20.00mL1.00mol?L-1氨水中,溶液pH随加入盐
室温下,将1.00mol?L-1盐酸滴入20.00mL1.00mol?L-1氨水中,溶液pH随加入盐查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?河西区一模)室温下,将1.00mol?Lˉ1盐酸滴入20.00mL 1.00mol?Lˉ1氨水中,溶液pH随加入盐酸体积变化的曲线如右图所示.下列说法正确的是( )
(2012?河西区一模)室温下,将1.00mol?Lˉ1盐酸滴入20.00mL 1.00mol?Lˉ1氨水中,溶液pH随加入盐酸体积变化的曲线如右图所示.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(℃)
室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(℃)+ 4 |
| 离子浓度的关系 | 溶质 | 溶液的pH | 物料守恒关系 | |
| ① | C(NH4+)>C(Cl-)>C(OH-)>C(H+) | NH4Cl、NH3?H2O NH4Cl、NH3?H2O |
pH>7 | / |
| ② | NH4Cl | / | c(NH4+)+c(NH3?H2O)=c(Cl-) c(NH4+)+c(NH3?H2O)=c(Cl-) | |
| ③ | C(Cl-)>C(H+)>C(NH4+)>C(OH-) | NH4Cl、HCl NH4Cl、HCl |
pH<7 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:
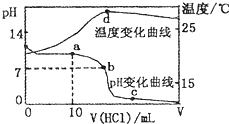 室温下,将1.00mol?L-1盐酸滴入20.00 mL 1.00mol?L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )
室温下,将1.00mol?L-1盐酸滴入20.00 mL 1.00mol?L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )A、a点溶液中离子浓度大小的关系:c(NH
| ||
B、b点溶液中离子浓度大小的关系:c(NH
| ||
C、c点溶液中离子浓度大小的关系:c(NH
| ||
| D、d点时溶液温度达到最高,之后温度略有下降,原因是NH3?H2O电离吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,将1.00mol • L-1盐酸滴人20. OO mL 1.OOmol • L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如下图所示。
下列有关说法中不正确的是
A.a点溶液中离子浓度大小的关系:
B.b点溶液中离子浓度大小的关系:
C.c点溶液中离子浓度大小的关系:
D.d点时溶液温度达到最高,之后温度略有下降,原因是NH3 • H2O电离吸热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com