
【题目】1 L某混合溶液,可能含有的离子如表所示:
可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH |
可能大量含有的阴离子 | Cl-、Br-、I-、CO |
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。

则该溶液中一定不含有的离子是________________________。
(2)BC段离子方程式为_______________________。
(3)V1、V2、V3、V4之间的关系为____________________。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2 L |
n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
n(I-) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为________。
【答案】 Mg2+、Fe2+、Fe3+、CO![]() 、AlO
、AlO![]() NH
NH![]() +OH-===NH3·H2O V2-V1=3(V4-V3) Cl2+2I-===I2+2Cl- 10∶15∶4
+OH-===NH3·H2O V2-V1=3(V4-V3) Cl2+2I-===I2+2Cl- 10∶15∶4
【解析】(1)①根据图象,开始加入NaOH没有沉淀和气体产生,则一定有H+;依据离子共存分析,一定不含有CO32-、AlO2-,开始加入V1无沉淀生成说明发生的反应是:H++OH-=H2O,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe2+、Fe3+,有Al3+;再加入氢氧化钠溶液至V2,图象分析可知生成沉淀增多至最大,反应为Al3++3OH-=Al(OH)3↓,消耗氢氧化钠溶液V2-V1,继续加入氢氧化钠,沉淀量不变,说明氢氧化钠和溶液中的铵根离子反应,NH4++OH-=NH3H2O,消耗氢氧化钠溶液V3-V2,继续加入氢氧化钠溶液,沉淀开始溶解,到加入V4氢氧化钠溶液,沉淀全部溶解,发生的反应为Al(OH)3+OH-=AlO2-+H2O,消耗氢氧化钠V4-V3;沉淀的质量不变,反应为NH4++OH-=NH3H2O的反应,则有NH4+;现象无法知道有无K+;
(1)综上所述一定含有H+、NH4+、Al3+,溶液中一定不含有的离子是Mg2+、Fe2+、Fe3+、CO32-、AlO2-;(2)BC段离子方程式为NH4++OH-=NH3H2O;(3)根据可知Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O可知V1、V2、V3、V4之间的关系为V2-V1=3(V4-V3);(4)①由于还原性:I->Br-,加入氯气2.8L时溶液中I-amol,则说明通入2.8LCl2只发生:Cl2+2I-=I2+2Cl-;②根据以上分析可知此时n(Cl2)=2.8L÷22.4L/mol=0.125mol,消耗n(I-)=2×0.125mol=0.25mol,生成n(Cl-)=2×0.125mol=0.25mol,此时n(Br-)=1.5mol,则说明原溶液中n(Br-)=1.5mol,根据表数据:2.8L变成5.6L,消耗2.8LCl2的物质的量为2.8L÷22.4L/mol=0.125mol,则
Cl2 +2Br-=Br2+2Cl-
0.05mol 0.1mol
Cl2+2I-=I2+2Cl-
0.075mol 0.15mol
则a=0.15mol,所以原溶液中:n(I-)=0.25mol+0.15mol=0.4mol,n(Cl-)=1.25mol-0.25mol=1mol,n(Cl-):n(Br-):n(I-)=1:1.5:0.4=10:15:4。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】(1)按如图所示操作,充分反应后:

①Ⅰ中发生反应的离子方程式为______________________________________;
②Ⅱ中铜丝上观察到的现象是________________________________________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为___________。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中还原产物是___________;若反应中转移了0.3 mol电子,则氧化产物的质量是___________g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2=== 2Fe3++2Cl-,这个事实说明FeBr2的溶液中具有还原性粒子的还原性强弱为___________。
(4)黑火药爆炸时发生反应:2KNO3+S+3C=K2S+N2↑+3CO2↑,2mol KNO3氧化碳的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:
①N2(g)+O2(g)=2NO(g) △H1= +180.5 kJmol-1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H2=-905 kJmol-1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6 kJmol-1
请写出N2和H2在高温、高压、催化剂条件下生成NH3的热化学方程式________________。
(2)在一定温度下,某恒容密闭容器中,发生反应:2X(g)+Y(g)![]() 2Z(g) △H<0,各物质的浓度随时间变化如图所示。
2Z(g) △H<0,各物质的浓度随时间变化如图所示。

①从反应开始到4min时平衡,Y的平均反应速率为____________________;
②根据图中数据,4min时的平衡常数K= ______________________;
③若使重新平衡时体系中c(X)=c(Z),则改变的条件为_____________________(只写一项)。
④若某时刻,V正(Y)=2V逆(Z),则反应_____达到平衡(填“已”或“未”)。
⑤图中a、b点对应的正反应速率大小关系为Va________Vb(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表5种元素。请填空:
(1) A元素基态原子的最外层有3个未成对电子,次外层有2个电子,写出A元素最外层电子的轨道表示式___________,A元素形成的气态氢化物中A原子的杂化类型为__________。
(2) B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为_______,C的元素符号为______。
(3) D元素的正三价离子的3d亚层为半充满,D的元素符号为_____,其基态原子的电子排布式为_______________。
(4) E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 用FeS除工业废水中Cu2+:Cu2+(aq)+FeS(s)═Fe2+(aq) +CuS(s)
B. 用惰性电极电解饱和MgCl2溶液:2Cl﹣+2H2O![]() Cl2↑+H2↑+2OH﹣
Cl2↑+H2↑+2OH﹣
C. FeBr2溶液中通入过量Cl2:2Fe2++2Br﹣+2Cl2═2Fe3++Br2+4Cl﹣
D. 向Na[Al(OH)4]溶液中滴加NaHCO3溶液:[Al(OH)4]-+ HCO3-═Al(OH)3↓+ CO2↑+ H20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3Cl2+8NH3=6NH4Cl+N2反应中,以下说法不正确的是
A. 还原剂是NH3 ,
B. 该反应中每生成1mol N2则转移的电子数为6NA
C. 氧化性大小顺序为:Cl2> N2
D. Cl2和NH3都可以用碱石灰来干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据新华社消息,卫生部拟从2011年12月1日起,禁止在面粉生产中使用过氧化苯甲酰和过氧化钙。过氧化苯甲酰的结构简式如图所示。

(1)过氧化苯甲酰的分子式为________,其一氯代物共有________种。
(2)工业上可以利用苯甲酰氯(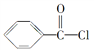 )和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式:___________________,该反应属于________反应。
)和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式:___________________,该反应属于________反应。
(3)过氧化苯甲酰用于面粉漂白后会产生苯甲酸:
![]()
![]() 。
。
苯甲酸的同分异构体中,属于酯类的有__________,属于酚类的有_________________ (写结构简式) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com