
【题目】下列比较中,正确的是( )
A. 同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B. 0.2 mol·L-1NH4Cl和0.1 mol·L-1NaOH溶液等体积混合后:c(![]() )>c(Cl-)>c(Na+)>c(OH-)>c(H+)
)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
C. 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
D. 同浓度的下列溶液中,①(NH4)2SO4、②NH4Cl、③CH3COONH4、④NH3·H2O;c(![]() )由大到小的顺序是:①>②>③>④
)由大到小的顺序是:①>②>③>④
【答案】D
【解析】
A.相同温度相同浓度时HF比HCN易电离,说明HF酸性大于HCN,酸性越强其相应酸根离子水解程度越小,相同浓度的钠盐溶液pH越小;
B.0.2 mol·L-1NH4Cl和0.1 mol·L-1NaOH溶液等体积混合后,溶液中的溶质为等物质的量浓度的NH4Cl、NH3.H2O、NaCl,一水合氨电离程度大于铵根离子水解程度导致溶液呈碱性,结合物料守恒判断;
C、任何电解质溶液中都存在电荷守恒;
D、1mol(NH4)2SO4能电离出2mol铵根离子,浓度最大;同浓度时铵根离子水解程度越大,则溶液中铵根离子浓度越小,醋酸根离子促进铵根离子水解;
A.相同温度相同浓度时HF比HCN易电离说明HF酸性大于HCN,酸性越强其相应酸根离子水解程度越小,相同浓度的钠盐溶液pH越小,水解能力CN->F-,所以相同浓度的钠盐溶液pH,NaF<NaCN,故A错误;
B.0.2 mol·L-1NH4Cl和0.1 mol·L-1NaOH溶液等体积混合后,溶液中的溶质为等物质的量浓度的NH4Cl、NH3.H2O、NaCl,一水合氨电离程度大于铵根离子水解程度导致溶液呈碱性,则c(OH-)>c(H+),一水合氨电离但程度较小,结合物料守恒得c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故B错误;
C、任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故C错误;
D、1mol(NH4)2SO4能电离出2mol铵根离子,浓度最大;相同浓度时铵根离子水解程度越大,则溶液中铵根离子浓度越小,醋酸根离子促进铵根离子水解,一水合氨是弱电解质,电离程度较小,所以c(NH4+)由大到小的顺是:①>②>③>④,故D正确;


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】用C、Mg和Al组成的混合物进行如下图所示实验。填写下列空白。
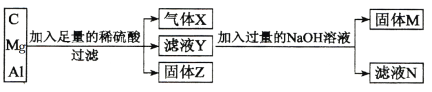
(1)气体X为 _________,固体Z为_____________。
(2)滤液Y中除H+外,还含有的阳离子为_________与__________;其中镁和稀硫酸反应的化学方程式为_________________________________________。
(3)滤液N中除Na2SO4和NaOH外,还含有的溶质为____________(填化学式);生成该物质的离子方程式为:________________________________。
(4)生成固体M的离子方程式为:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体 | Na2O2没有变质 |
B | 取少许CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液,最终无淡黄色沉淀 | CH3CH2Br没有水解 |
C | 室温下,用pH试纸测得:0.1 mol·L-1 Na2SO3溶液的pH约为10,0.1 mol·L-1 NaHSO3溶液的pH约为5 | HSO |
D | 向少量碘水中加入过量浓FeCl2溶液,分成两等份,向一份中滴加KSCN溶液显红色;向另一份中滴加淀粉溶液显蓝色 | Fe3+与I-的反应为可逆反应 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿(CuFeS2)、FeCl3和乳酸[CH3CH(OH)COOH]为原料可制备有机合成催化剂CuCl和补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}。其主要实验流程如下:

(1) FeCl3溶液与黄铜矿发生反应的离子方程式为___________________________________________。
(2)向溶液1中加入过量铁粉的目的是_______________________________________________。
(3)过滤后得到的FeCO3固体应进行洗涤,检验洗涤已完全的方法是__________________________。

(4)实验室制备乳酸亚铁的装置如图所示。
①实验前通入N2的目的是_______________________________________。
②某兴趣小组用KMnO4滴定法测定样品中Fe2+含量进而计算产品中乳酸亚铁的质量分数,结果测得产品的质量分数总是大于100%,其原因可能是_______________________________________________。
(5)已知:
①CuCl为白色晶体,难溶于水和乙醇,在空气中易氧化;可与NaCl溶液反应,生成易溶于水的NaCuCl2。
②NaCuCl2可水解生成CuCl,温度、pH对CuCl产率的影响如图所示。


由CuCl(s)、S(s)混合物提纯CuCl的实验方案为:将一定量的混合物溶于饱和NaCl溶液中,________________________________________________________________________。(实验中须使用的试剂有:饱和NaCl溶液,0.1 mol·L-1 H2SO4、乙醇;除常用仪器外须使用的仪器有:真空干燥箱)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对文中描述内容的相关解释正确的是( )
选项 | 描述 | 解铎 |
A | 丹砂烧之成水银,积变又还成丹砂 | 两个反应互为可逆反应 |
B | 凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之 | 其中“瓦”的主要成分为硅酸盐 |
C | 硝石(KNO3)如握盐雪不冰,强烧之,紫青烟起 | 产生“紫青烟”的原因为KNO3分解 |
D | 其法用浓酒精和槽入瓶,蒸令气上,用器承滴露 | 其中涉及的操作方法为蒸发浓缩 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某双原子分子构成的气体,其摩尔质量为32g/mol,该气体质量为16g,阿伏加德罗常数为NA,则:
(1)该气体的物质的量为________
(2)该气体在标准状况下的体积约为________
(3)该气体所含原子总数为________
(4)该气体的一个分子的质量为________
(5)该气体在标准状况下的密度约为________(保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硫及其化合物在工农业生产生活中有着重要作用。回答下列问题:
(1)有人设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0 kJ·mol1、283.0 kJ·mol1,请写出CO还原SO2的生成CO2和S(s)热化学方程式________________。
(2)某科研小组研究臭氧氧化碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
已知该体系中臭氧发生分解反应:2O3(g)![]() 3O2(g)。请回答:其它条件不变,每次向容积为2 L的反应器中充入含2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
3O2(g)。请回答:其它条件不变,每次向容积为2 L的反应器中充入含2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
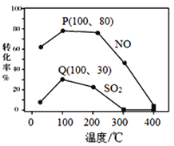
①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_____________________________________________________________________________。
②下列说法正确的是________。
A.Q点一定为平衡状态点
B.其它条件不变,若扩大反应器的容积可提高NO和SO2的转化率
C.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
③假设100℃时P、Q均为平衡点,此时反应时间为5min,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是___________;SO2的平均反应速率为________;反应Ⅰ在此时的平衡常数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素[CO(NH2)2] 是首个由无机物合成的有机化合物,通常用作植物的氮肥。合成尿素的主要反应如下:
i. 2NH3(l) + CO2(g) ![]()
![]() (l)(氨基甲酸铵) △H=-a kJ/mol
(l)(氨基甲酸铵) △H=-a kJ/mol
ii. ![]() (l)
(l) ![]()
![]() (l) + H2O(l) △H=+b kJ/mol
(l) + H2O(l) △H=+b kJ/mol
iii. 2![]()
![]()
![]() (缩二脲)+NH3 (副反应,程度较小)
(缩二脲)+NH3 (副反应,程度较小)
(1)实验室制取氨气的化学方程式是__________________。
(2)CO(NH2)2中C为+4价,N的化合价_______。
(3)CO2和NH3合成尿素的热化学方程式为___________________________。
(4)工业上提高氨碳比(![]() ),可以提高尿素的产率,结合反应i~iii,解释尿素产率提高的原因______。
),可以提高尿素的产率,结合反应i~iii,解释尿素产率提高的原因______。
(5)某科研小组模拟工业合成尿素,一定条件下,在0.5L的密闭容器中投入4molNH3和1molCO2,测得反应中各组分的物质的量随时间变化如图1所示:

①反应进行到10min时,用CO2表示反应i的速率υ(CO2)=________。
②合成总反应的快慢由慢的一步决定,则合成尿素的总反应的快慢由第______步反应决定(填“i”或“ii”)。
(6)我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图2)。总反应为:CO(NH2)2+H2O![]() 3H2↑+N2↑+CO2↑。
3H2↑+N2↑+CO2↑。
①A电极连接电源的_______极(填“正”或“负”)。
②A电极的电极反应为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的一种重要还原剂。一般的制备方法是将AlC13溶于有机溶剂,再把所得溶液滴加到NaH粉末上,可制得铝氢化钠。实验要求和装置如下,回答下列问题:
(1)制取铝氢化钠要在非水溶液中进行,主要原因是_______(用化学方程式表示)。用下列装置制取少量铝氢化钠(含副产物处理)较为合理的是__________。

(2)对于原料A1C13的制取,某兴趣小组设计了如下装置:

①连接好装置后,应进行的第一步操作是_________;为保证产物的纯净,应待D中__________(填现象)再加热酒精灯。
②B装置中盛装饱和NaCl溶液,实验开始后B中产生的现象是_________,选择饱和NaCl溶液的理由是_____。
③C装置的作用是_________;若无C装置,试预测实验后D中生成物除A1C13外可能还含有_________。(填化学式)
④上述装置存在的明显缺陷是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com