
【题目】为测定某地空气中SO2和可吸入颗粒的含量,某同学设计了如下图所示的实验装置:

注:气体流速管是用来测量单位时间内通过气体体积的装置
(1)上述实验测定原理为_________________________________ (用化学方程式表示)。
(2)应用上述装置测定空气中SO2和可吸入颗粒的含量,除需测定气体流速(单位:mL·s-1)外,还需要测定碘溶液蓝色褪去所需的时间和___________________________。
(3)己知:碘单质微溶于水,KI可以增大碘在水中溶解度。为精确配制100 mL 5.0×10-4mol·L-1的碘溶液,先要配制1000 mL 1.0×10-2mol·L-1碘溶液,再取5.00 mL溶液稀释成为5.0×10-4mol·L-1碘溶液。
①第一步:用托盘天平称取___ g 碘单质加入烧杯中,同时加入少量碘化钾固体,加适量水搅拌使之完全溶解。
②第二步:________________,洗涤、定容、摇匀。
③第三步:用第二步所得溶液配制5.0×10-4mol·L-1碘溶液,此步操作中,除烧杯、玻璃棒、胶头滴管外还需要的玻璃仪器有________________________。
(4)空气中SO2含量的测定:
①已知空气中二氧化硫的最大允许排放浓度不得超过0.02mg·L-1,在指定的地点取样,以200mL·s-1气体流速通过气体流速管通入到上图实验装置中,观察记录碘溶液褪色所需时间为500s,则该地空气中的SO2含量是________ mg·L-1,____________(填“符合”、“不符合”)排放标准。
②如果甲同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,其原因可能是________________________________(假设溶液配制、称量或量取及各种读数均无错误。写出一种可能原因即可)
【答案】 SO2+I2+2H2O = H2SO4+2HI 装置A在反应前后的质量 2.5 将第一步所得溶液全部转入1000 mL容量瓶中 酸式滴定管(或移液管),100mL 容量瓶 0.016 符合 气体流速过快,吸收不完全(或未充分反应);装置气密性较差
【解析】分析:该实验的目的是测定某地空气中SO2和可吸入颗粒的含量,通过气体流速管可测出实验过程中通过的空气体积,通过测量装置A在实验前后的增重量可求出可吸入颗粒的含量,通过测量装置B中一定量的淀粉碘溶液的褪色时间可求出SO2的含量;第3问要掌握一定物质的量浓度溶液的配制操作和仪器的使用;第4问通过反应方程式计算出空气中SO2的含量是否达到排放标准以及产生误差的原因。
详解:(1)上述实验测定中的主要反应原理为SO2+I2+2H2O = H2SO4+2HI。
(2)还需要测量装置A在反应前后的质量,即可求得可吸入颗粒的含量。
(3) ①由题目叙述要先配制1000 mL 1.0×10-2mol·L-1碘溶液,所以需要用托盘天平称量单质碘的质量为=1L×1.0×10-2mol·L-1×254g/mol=2.5g,放在烧杯中再加少量碘化钾固体,加适量水搅拌使之完全溶解;②冷却后全部转入1000 mL容量瓶中,洗涤、定容、摇匀;③用酸式滴定管(或移液管)取所配碘溶液5.00 mL于小烧杯中,加水稀释后全部转移到100 mL容量瓶中,再经过洗涤、定容、摇匀即得100 mL 5.0×10-4mol·L-1的碘溶液,此步操作中,除烧杯、玻璃棒、胶头滴管外还需要的玻璃仪器有:酸式滴定管(或移液管)和100 mL容量瓶。
(4) ①已知气体流速为200mL·s-1,通过的时间为500s,所以空气的体积为100L,又n(I2)= 0.05L×5.0×10-4mol·L-1=2.5×10-5mol,由反应方程式可得n(SO2)= 2.5×10-5mol,所以该地空气中的SO2含量为[2.5×10-5mol×64g/mol×1000mg/g]/100L=0.016mg/L<0.02mg·L-1,所以符合排放标准;②如果实验测得的数值比实际含量低,可能的原因为气体流速过快,SO2没有完全被吸收、或SO2与I2没有完全反应、或者装置气密性不好。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是( )
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 与![]() 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
C. 含有5个碳原子的某饱和链烃,其一氯取代物可能有8种
D. 菲的结构式为 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物Targretin(F)能治疗顽固性皮肤T—细胞淋巴瘤,其合成路线如下图所示:

(1)反应①的反应类型是______________。
(2)反应②的化学方程式:__________________________________________。
(3)C的核磁共振氢谱图中有______________个峰。
(4)反应③的化学方程式:__________________________________________。
(5)F的分子式是C24H28O2. F中含有的官能团:__________________________。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑—O—O—或![]() 结构):_______________________________________________________________。
结构):_______________________________________________________________。
a.苯环上的一氯代物有两种 b.既能发生银镜反应又能发生水解反应
(7)已知:![]() 。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成![]() 合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。
合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。

(1)图甲中,1号C与相邻C形成σ键的个数为__________。
(2)图乙中,1号C的杂化方式是__________,该C与相邻C形成的键角__________(填“>”、“<”或“=”)图甲中1号C与相邻C形成的键角。
(3)我国制墨工艺是将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是____________________。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为____________,该材料的化学式为_______________。
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________。
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。

①“可燃冰”中分子间存在的2种作用力是___________________________;
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,结合图表从物质结构及性质的角度分析,该设想的依据是:______________________________。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )
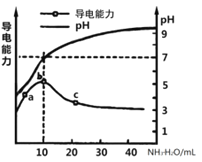
A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)基态铜原子的电子排布式为_____________;已知高温下CuO![]() Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___________________________。
Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___________________________。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的最简单的氢化物中,分子构型分别为____________, 若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se____Si (填“>”、“<”)。人们把硅与氢元素形成的一类化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是_____________________________________________。

(3)与铟、镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤电子对的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为______, B与N之间形成___________键。
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如下图所示,则金刚砂晶体类型为_________________,在SiC中,每个C原子周围最近的C原子数目为___个;若晶胞的边长为a pm,则金刚砂的密度为____g/cm3 (用NA表示阿伏伽德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、 F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 地壳中含量最多的元素 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
(1) B元素符号为____,A与C以原子个数比为1:1形成的化合物的电子式为___,用电子式表示C与E形成化合物的过程____, D形成的简单离子的结构示意图为____。
(2) F的氢化物是由____(极性或非极性)键形成的分子,写出实验室制备该氢化物的化学方程式____。
(3) 非金属性D____E(填大于或小于),请从原子结构的角度解释原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分为Al2O3,还有少量杂质)中提取铝的工艺流程及步骤如下:
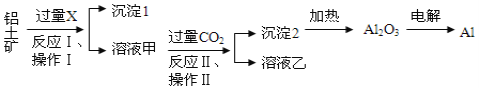
试回答下列问题:
(1)试剂X为__________;
(2)操作Ⅰ、操作Ⅱ均为_____________(填操作名称),在实验室进行该操作时需要的玻璃仪器有__________________________________;
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应,该反应的化学方程式为_______________________________,请举一例该反应的用途________________________;
(4)反应Ⅱ的离子方程式为____________________________________________________;
(5)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com