
【题目】将钠投入水中后,钠融化成一个小球,根据这一现象你能得出的结论是① , ② . 钠与水反应的离子方程式是 .
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素。如图是实验室从海藻里提取碘的流程的一部分。下列判断正确的是

A. 步骤④的操作是过滤
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤①、③的操作分别是过滤、萃取
D. 步骤③中加入的有机溶剂可能是酒精或四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应Al2O3+N2+3C ![]() 2AlN+3CO的叙述正确的是
2AlN+3CO的叙述正确的是
A. Al2O3是氧化剂,C是还原剂 B. 每生成1 mol CO需转移2 mol电子
C. AlN中氮元素的化合价为+3 D. N2发生了氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柴静雾霾调查纪录片《穹顶之下》中的PM2.5是空气污染物之一,其中PM2.5 指( )
A. 固体小颗粒 B. SO2 C. 氮氧化物 D. CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,依次通过的洗气瓶中盛放的试剂最好为( )
A.澄清石灰水、浓硫酸B.KMnO4酸性溶液、浓硫酸
C.溴水、浓硫酸D.浓硫酸、KMnO4酸性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素在电化学中应用广泛。回答下列问题:
(1)根据反应2Fe3++Cu==2Fe2++Cu2+设计原电池如图。电流计显示电流方向为:a→b。

①电极B为____________,电解质溶液C为_____________。(填标号)
A,碳棒 B.铜片 C.Fe2(SO4)3溶液 D.CUSO4溶液
②A电极的电极反应式为________________________________________。
③用该电池做电源,电解硫酸钠溶液,当电解池阳极有11.2mL气体(标准状况)产生时,该电池有__________________molFe3+被还原。
(2)NaFeO4是一种用途广泛的化工产品,工业上常用电解法制取。制取装置如图。已知Na2FeO4只在强碱性条件下比较稳定,具有强氧化性。

①Na2FeO4中铁元素化合价为_____________ Na2FeO4是具有杀菌效果的净水剂。原因是_________________________________________________。
②电极Ni为_________________(填“阳”或“阴”)极。为使该装置能持续反应,离子交换膜应为__________________________(填“阳”或“阴”)离子交换膜。
③阳极反应式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测
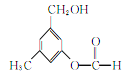
①可以使酸性高锰酸钾溶液褪色
②可以和NaOH溶液反应
③在一定条件下可以和乙酸发生反应
④在一定条件下可以发生消去反应
⑤在一定条件下可以和新制Cu(OH)2反应
⑥遇FeCl3溶液可以发生显色反应
其中正确的是( )
A. ①②③⑥ B. ①②③⑤ C. ①②③④ D. ①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-181.6 kJ·mol-1;
CH3OH(g)+H2O(g) ΔH1=-181.6 kJ·mol-1;
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1。
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式:________________________________________________________________________。
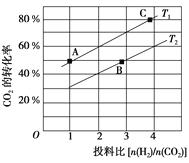
(2)在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)=______________________________;KA、KB、KC三者之间的大小关系为______________________________。
(3)若2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是________(填序号)。
CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是________(填序号)。
A.CO和H2的物质的量浓度之比是1∶2
B.CO的消耗速率等于CH3OCH3的生成速率的2倍
C.容器中混合气体的体积保持不变
D.容器中混合气体的平均摩尔质量保持不变
E.容器中混合气体的密度保持不变
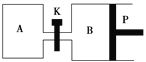
(4)如图P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1 mol CH3OH(g)和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH转化率为________;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
CO2(g)+3H2(g)。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH转化率为________;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(5)CO2溶于水形成H2CO3。已知常温下H2CO3的电离平衡常数为K1=4.4×10-7、K2=4.7×10-11,NH3·H2O的电离平衡常数为K=1.75×10-5。常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显________(填“酸性”“中性”或“碱性”);请计算反应NH+HCO+H2O![]() NH3·H2O+H2CO3的平衡常数K=________________________________________________________________________。
NH3·H2O+H2CO3的平衡常数K=________________________________________________________________________。
(6)工业上采用电化学还原CO2是一种使CO2资源化利用的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应),下列说法正确的是____________。
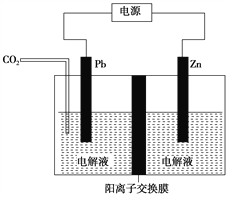
A.Zn与电源的负极相连
B.ZnC2O4在交换膜右侧生成
C.电解的总反应式为2CO2+Zn![]() ZnC2O4
ZnC2O4
D.通入11.2 L CO2,转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com